Specialty研究内容
研究内容の詳細
3.臨床研究
3.1抗CCR4抗体と抗PD-1抗体の併用治療(医師主導治験)
がん患者では、制御性T 細胞が抗腫瘍免疫反応を抑制していることが知られている。制御性T細胞のうち、特に活性化制御性T 細胞は膜表面にCCR4 を発現することから、担癌患者へのMogamulizumab 投与により活性化制御性T 細胞分画を除去し、抗腫瘍免疫の増強による臨床効果をもたらすことが可能となる。また、腫瘍細胞の直接的作用を持つ細胞傷害性T 細胞に発現するPD-1 は、腫瘍細胞膜上に存在するPD-L1 あるいはPD-L2 と結合することで、細胞傷害性T細胞の腫瘍細胞に対する作用を抑制している。このためPD-1-PD-L1 経路のアンタゴニストであるNivolumab 投与により腫瘍免疫の増強効果が得られる。そこで、それぞれの持つ抗腫瘍効果を相加・相乗的に発揮するものと期待して、2 剤を併用する医師主導治験が大阪大学(和田尚教授)を主幹として多施設で実施された。東大病院から、呼吸器外科中島淳教授を試験責任医師として、泌尿器科(久米春喜教授)、胃食道外科(瀬戸泰之教授)、免疫細胞治療学講座が参加した。
免疫制御薬を術前に投与し、その効果を手術検体で解析することができる非常に貴重な臨床研究である。免疫細胞治療学講座では、腫瘍から抽出したDNA/RNAをNGS解析し、トランスクリプトーム解析、イムノグラム解析、TCRレパトア解析などを担当している。
3.2γδT細胞治療
γδT細胞(緑:生きたがん細胞、死んだがん細胞は色を失う。→:γδT細胞)
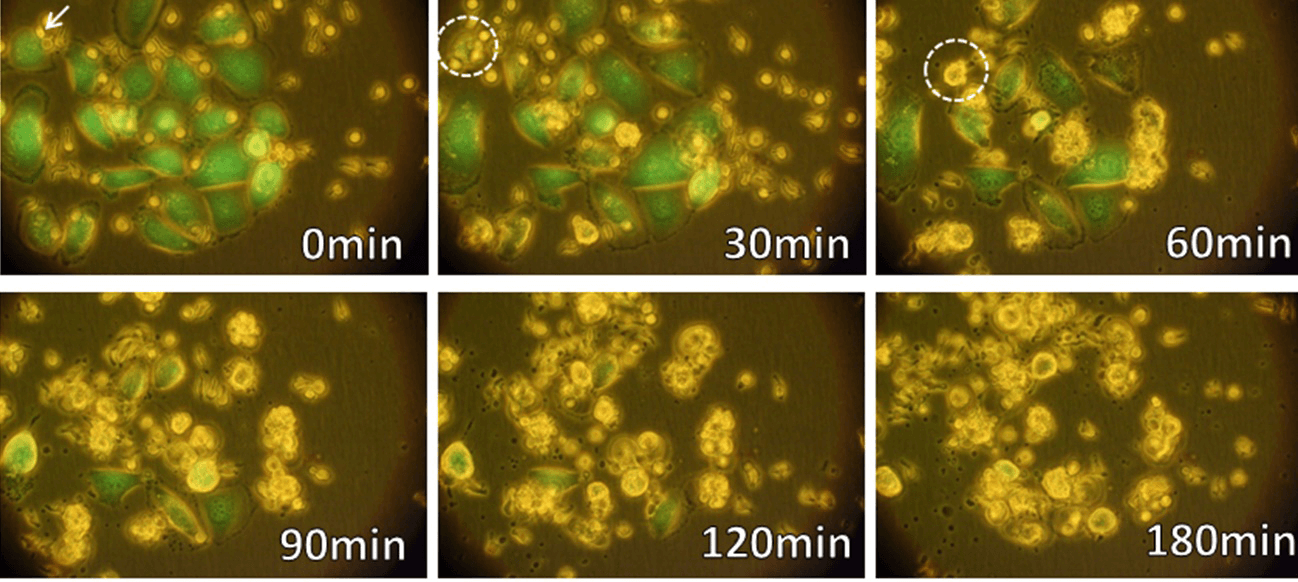
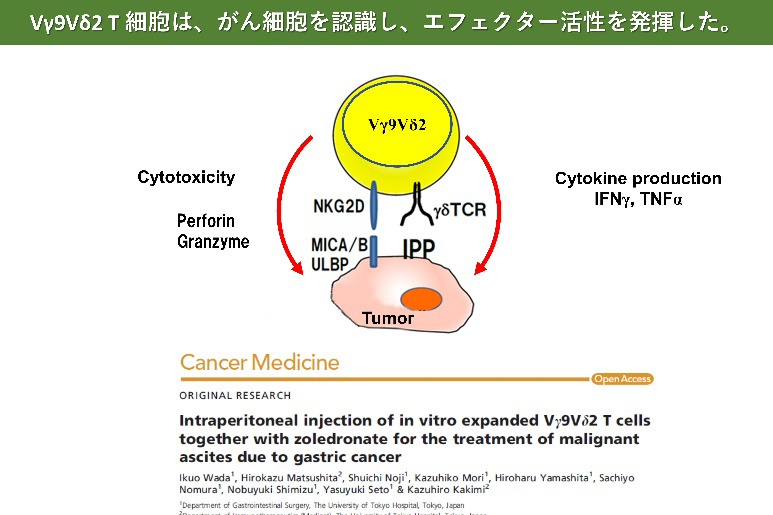
γδT細胞は血液中のリンパ球の一種であり、がんや感染症などから生体を防御する役割や傷害を受けた組織の修復を助ける働きを担っている。がん細胞では、メバロン酸代謝が正常細胞と異なり、その中間代謝産物であるイソペンテニルピロリン酸(IPP)が蓄積している。γδT細胞は、T細胞受容体(TCR)を介してIPPを認識し、がん細胞を検知して細胞傷害活性を示すことができる。また、TCRを介してがん細胞表面上のAPO-A-1やF1-ATPase等の分子を認識する。さらに、γδT細胞表面に発現するNKG2D分子は、発がんあるいは感染、放射線照射などによって誘導されるがん細胞表面分子MICA/BあるいはULBPに結合して、標的となるがん細胞の認識効率を高めている。γδT細胞は、このようにがん細胞の表面に発現する分子を主要組織適合抗原(MHC)に拘束されることなく認識することで腫瘍細胞と正常細胞を区別し、腫瘍細胞に対する細胞傷害活性を示すことに加えて、サイトカインを産生するなどして抗腫瘍活性を発揮する。これらのメカニズムにより、γδT細胞は、肺がん、食道がん、胃がん、大腸がん、膵臓がん、腎細胞がん、白血病、リンパ腫など、がん種を問わず様々ながんに対する抗腫瘍活性を示すことが特徴である。さらに、MHC分子の発現を低下もしくは消失させることにより細胞傷害性Tリンパ球(CTL)による免疫監視機構を回避した腫瘍に対しても、γδT細胞の認識機構は対応可能であることから、抗腫瘍活性が期待される。
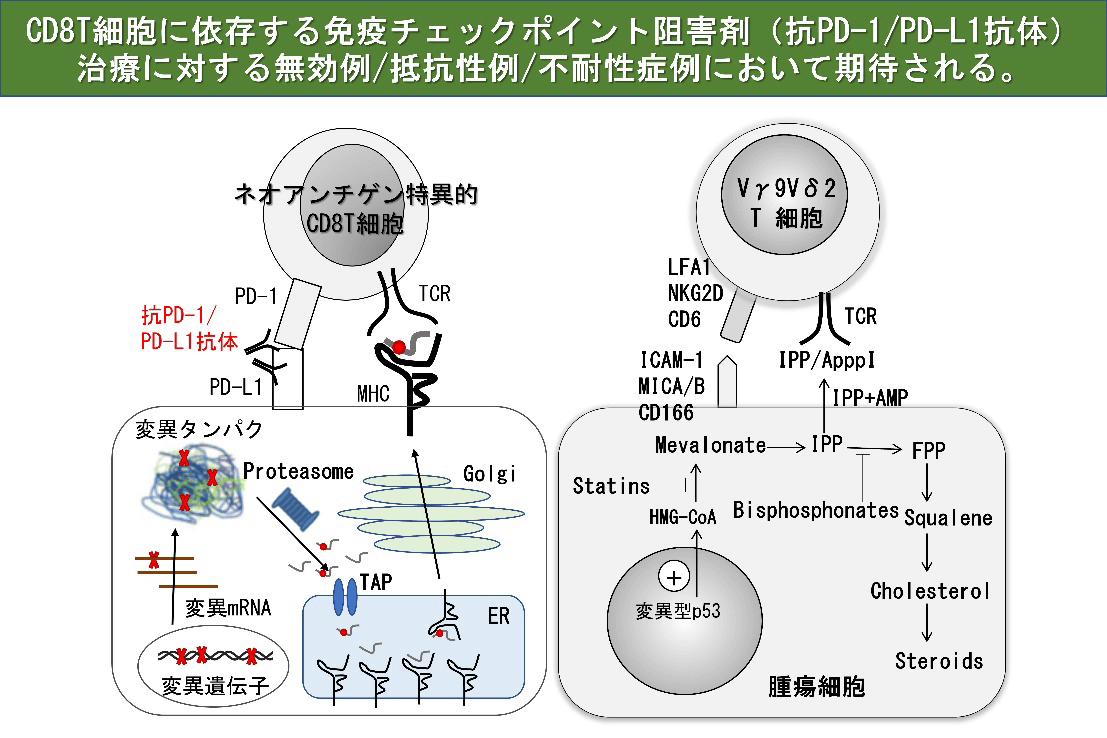
我々は、ゾレドロン酸とインターロイキン-2(IL-2)を用いて γδT細胞を安定的に大量に増殖させる培養技術を確立した。この細胞を用いて、肺がん、食道がん、胃がん、肝細胞がん、膵がん、胆道がん、結腸癌肺転移、乳がんや前立腺がんの骨転移に対する免疫細胞治療の臨床試験を実施した。

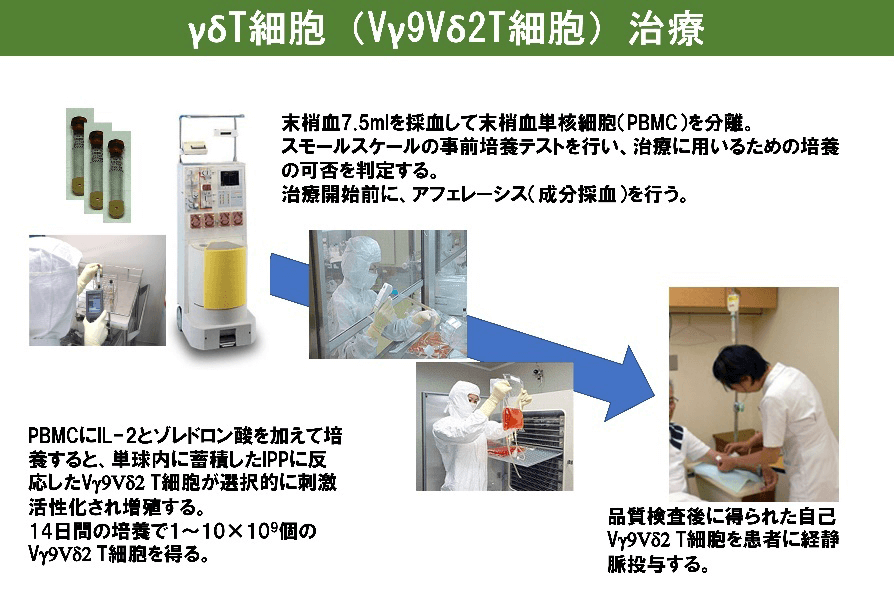
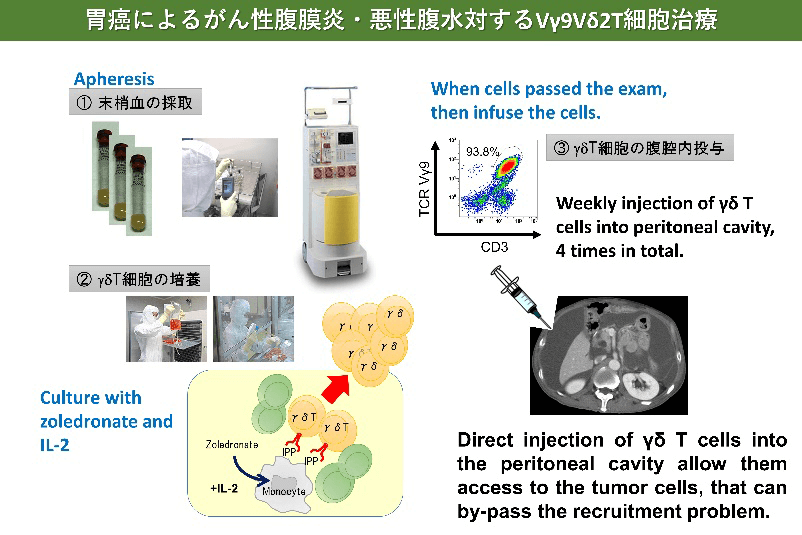
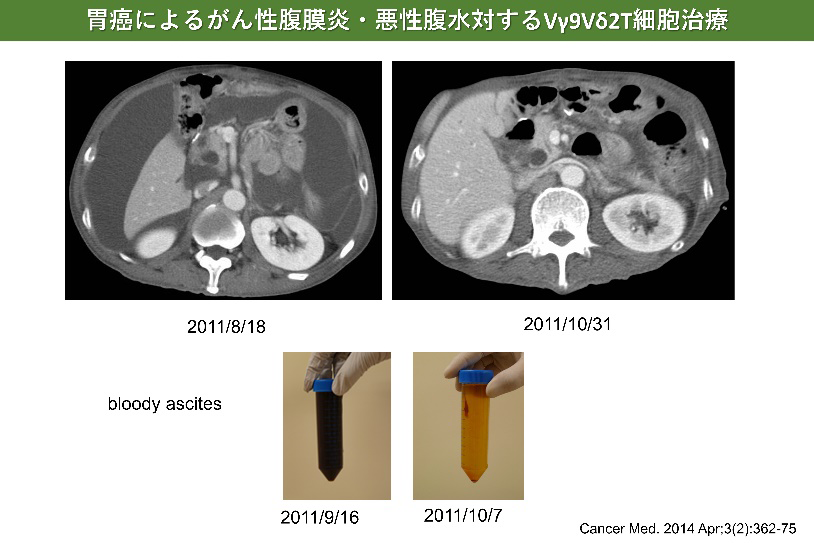
胃がんに対するγδT細胞治療
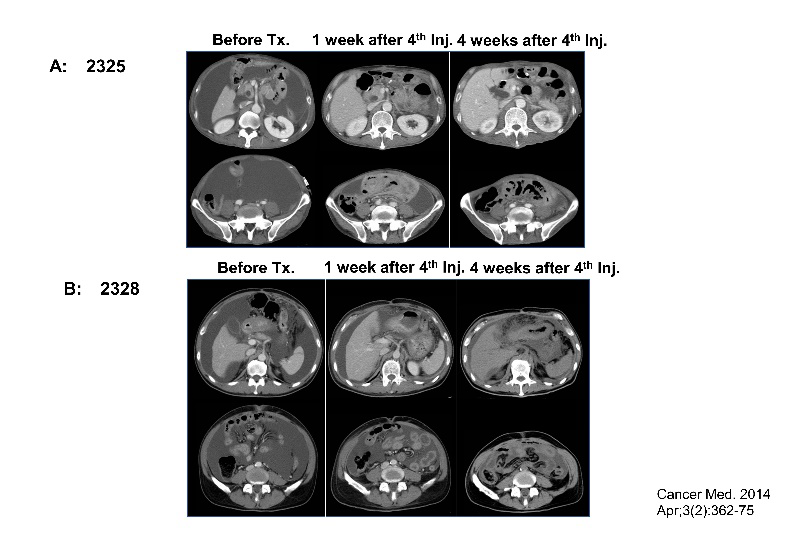
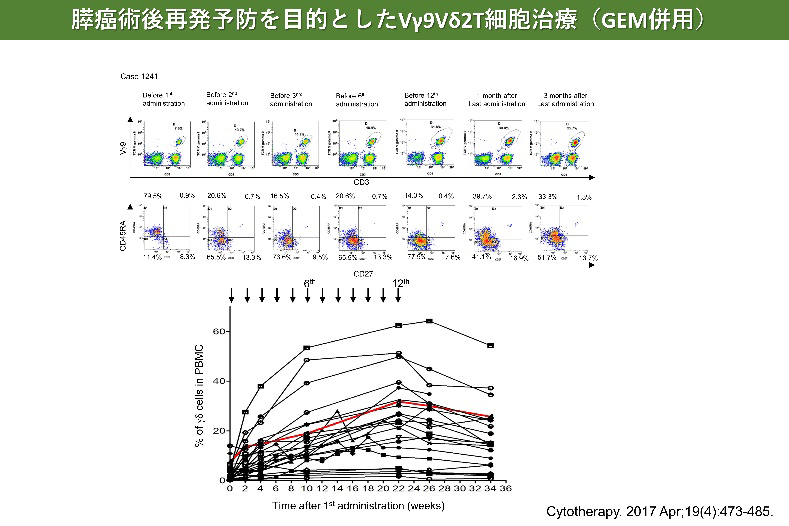
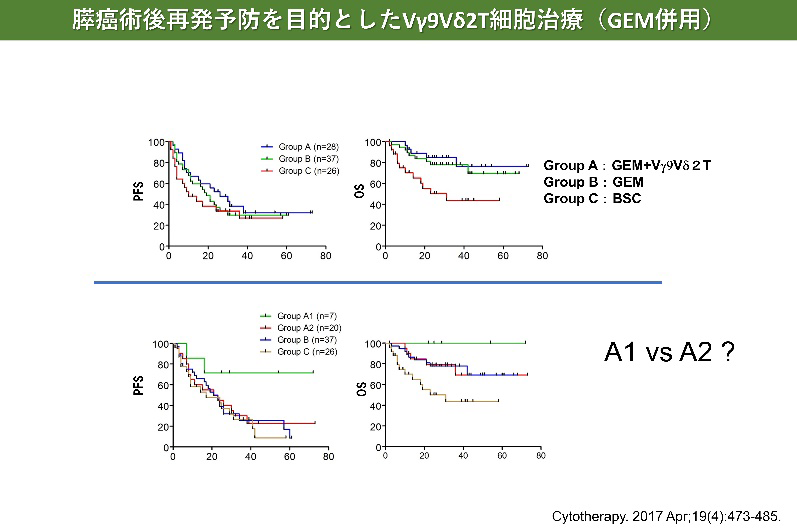
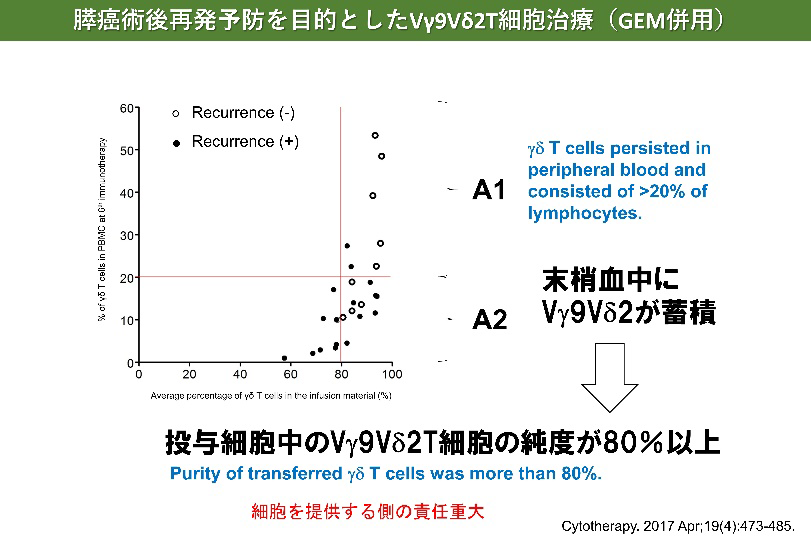
膵がんに対するγδT細胞治療
肺がんに対するγδT細胞治療
東京大学医学部附属病院において進行再発非小細胞肺癌15例に対してゾレドロン酸誘導 γδ T細胞を用いた免疫細胞治療を施行した(UMIN試験ID:C000000336)。6回投与終了4週間後の時点で6症例が病勢の安定(stable disease, SD)、6症例が病勢進行(progressive disease, PD)、判定不能3例であり、病勢コントロール率は40.0%であった。中央生存期間は589日であり、中央無増悪生存期間は126日であった。そこで、非小細胞肺癌に対するγδT細胞治療の無増悪生存期間を評価・検討することを目的に第II相試験として先進医療を開始した。慶應義塾大学病院を加え2施設でγδT細胞治療を提供した。

本試験は、標準治療抵抗性の肺がん患者に対するγδ T細胞治療の評価を目的に、肺がんに対するサードラインの治療として試験をデザインした。しかしながら、分子標的薬及び免疫チェックポイント阻害剤の登場で肺がんに対する標準治療が大きく変化し、多岐にわたる新規治療薬が承認されるたびに、本治療へのエントリーが後ろに回り、ラストラインの治療としてほぼベストサポーティブケアになった患者を対象患者とせざるを得なかった。すでに複数の肺がん治療を受け、病勢が進行して非常に厳しい状態で本試験への候補として紹介される事例では、PSの低下が著しくエントリーには不適格と判断された。特に平成27年12月に、「切除不能な進行・再発の非小細胞肺癌」に対して、抗PD-1抗体(ニボルマブ)が承認されて以降、多くの肺がん患者がニボルマブ治療の効果を期待して、γδ T細胞治療への参加前にニボルマブ治療が組み込まれて新規症例の試験への組み込みが遅延した。本試験はニボルマブ併用治療ではないが、体内に残存するニボルマブがγδ T細胞に及ぼす影響が明らかになっていなかっため、血清ニボルマブ消失半減期(13±7日)を用いてニボルマブ投与歴のある患者は、ニボルマブ最終投与日から3ヶ月間のwash-out期間をあけてγδT細胞治療を開始し、試験治療開始後も注意深く経過観察を行うこととした。進行肺がん患者にとって、3ヶ月は非常に厳しく、この間に病勢の進行やPSの低下でエントリーが困難になった。また、先行治療の影響で半数以上の症例では培養困難に陥り、エントリー症例数が限定されてしまった。予定症例85例に対して25例の実施にとどまってしまったが、ニボルマブに続いてペンブロリズマブ、アテゾリズマブ等の免疫疫チェックポイント阻害剤が承認され、肺がんの標準治療が大きく変化したため、対象患者の再設定を含めた試験デザインの再考が必要と考え、本試験を終了した。
従来の治療法に抵抗性を有する非小細胞肺がんに対して、ゾレドロン酸を用いて患者自己末梢血単核細胞から誘導したγδT細胞を用いた免疫療法は、目標症例数未達で終了となり、有効性を示すことはできなかったが、安全に実施することが可能であった。強い免疫反応とともに腫瘍縮小を認めた症例を経験し、本治療法のPOCが再確認できた点は非常に有意義であった。
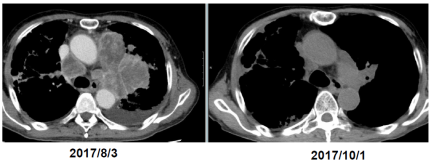
また、本試験では、投与されたγδT細胞が患者の体内に蓄積する動態を詳細に観察することができた。これらの知見は、今後開発が期待されている遺伝子導入T細胞治療などへの応用に向けて、細胞治療開発に関わるコミュニティにとって基盤となる貴重なデータである。また培養に伴う核型異常を認めたことは、細胞治療のみならず広く再生医療に携わる研究者にとって、安全性の検証やリスク管理の重要性を再認識させることとなった。
γδT細胞治療は、単剤治療としては、セカンドラインで肺がん治療に用いられる化学療法剤や分子標的薬と同程度の効果を認めた。免疫チェックポイント阻害剤(ICI)と異なる作用機序を持つ本治療は、今後ICIとの併用治療あるいは、ICI無効例・抵抗例を対象として治療法として、試験デザインを再考し評価したい。
| セカンドライン治療(単剤) | |||
|---|---|---|---|
| 一般薬剤名 | 無増悪生存期間 | 全生存期間 | |
| (中央値) | (中央値) | ||
| ペメトレキセド 23,24) | 2.9ヶ月 | 8.3ヶ月 | |
| ドセタキセル 25) | 3.4ヶ月 | 7.8ヶ月 | |
| ゲフィニチブ 26) | 2ヶ月 | 11.5ヶ月 | |
| エルロチニブ 27) | 2.2ヶ月 | 6.7ヶ月 | |
| チェックポイント阻害剤 | |||
| ニボルマブ 28) | Checkmate-017 扁平上皮がん |
3.5ヶ月 | 9.2ヶ月 |
| ドセタキセル | 2.8ヶ月 | 6.0ヶ月 | |
| ニボルマブ 29) | Checkmate-057 非扁平上皮がん |
2.3ヶ月 | 12.2ヶ月 |
| ドセタキセル | 4.2ヶ月 | 9.4ヶ月 | |
| γδT細胞治療(本試験) | 先進医療 | 3.2ヶ月(95日) | 14.1ヶ月(424日) |
- 発表論文
-
- Kondo M, Sakuta K, Noguchi A, Ariyoshi N, Sato K, Sato S, Sato K, Hosoi A, Nakajima J, Yoshida Y, Shiraishi K, Nakagawa K, Kakimi K. Zoledronate facilitates large-scale ex vivo expansion of functional γδ T cells from cancer patients for use in adoptive immunotherapy. Cytotherapy. 2008;10(8):842-56.
- Sato K, Kondo M, Sakuta K, Hosoi A, Noji S, Sugiura M, Yoshida Y, Kakimi K. Impact of culture medium on the expansion of γδ T cells for immunotherapy. Cytotherapy. 2009;11(7):936-46.
- Nakajima J, Murakawa T, Fukami T, Goto S, Kaneko T, Yoshida Y, Takamoto S, Kakimi K. A phase I study of adoptive immunotherapy for recurrent non-small-cell lung cancer patients with autologous γδ T cells. Eur J Cardiothorac Surg. 2010 May;37(5):1191-7.
- Sakamoto M, Nakajima J, Murakawa T, Fukami T, Yoshida Y, Murayama T, Takamoto S, Matsushita H, Kakimi K. Adoptive immunotherapy for advanced non-small cell lung cancer using zoledronate-expanded γδ Tcells: a phase I clinical study. J Immunother. 2011 Mar;34(2):202-11.
- Yoshida Y, Nakajima J, Wada H, Kakimi K. γδ T-cell immunotherapy for lung cancer. Surg Today. 2011 May;41(5):606-11.
- Kondo M, Izumi T, Fujieda N, Kondo A, Morishita T, Matsushita H, Kakimi K. Expansion of human peripheral blood γδ T cells using zoledronate. J Vis Exp. 2011 Sep 9;(55):3182.
- Izumi T, Kondo M, Takahashi T, Fujieda N, Kondo A, Tamura N, Murakawa T, Nakajima J, Matsushita H, Kakimi K. Ex vivo characterization of γδ T-cell repertoire in patients after adoptive transfer of Vγ9Vδ2 T cells expressing the interleukin-2 receptor γ-chain and the common γ chain. Cytotherapy. 2013 Apr;15(4):481-91.
- Kakimi K, Matsushita H, Murakawa T, Nakajima J. γδ T cell therapy for the treatment of non-small cell lung cancer. Transl Lung Cancer Res. 2014 Feb;3(1):23-33.
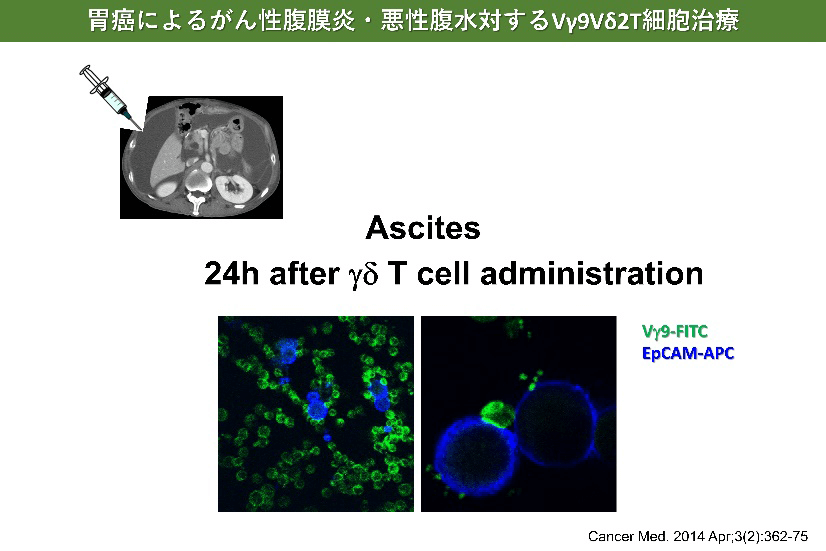
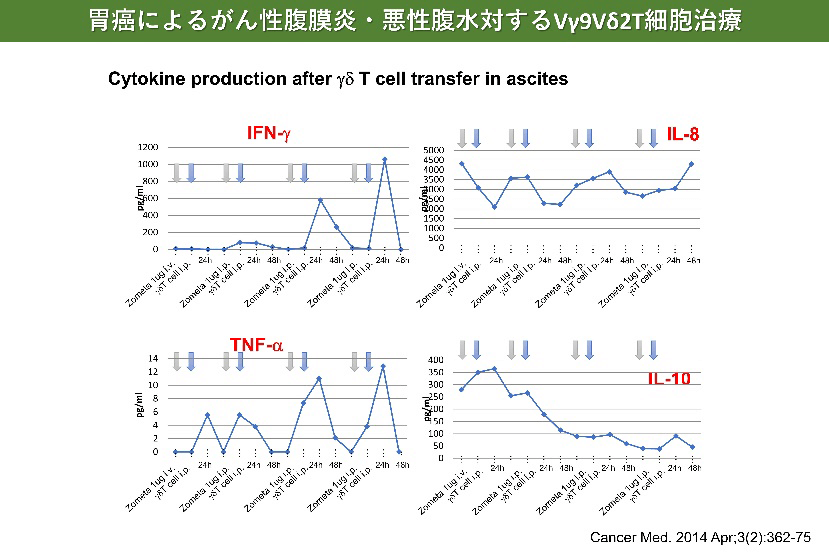
- Wada I, Matsushita H, Noji S, Mori K, Yamashita H, Nomura S, Shimizu N, Seto Y, Kakimi K. Intraperitoneal injection of in vitro expanded Vγ9Vδ2 T cells together with zoledronate for the treatment of malignant ascites due to gastric cancer. Cancer Med. 2014 Apr;3(2):362-75.
- Odaira K, Kimura SN, Fujieda N, Kobayashi Y, Kambara K, Takahashi T, Izumi T, Matsushita H, Kakimi K. CD27(-)CD45(+) γδ T cells can be divided into two populations, CD27(-)CD45(int) and CD27(-)CD45(hi) with little proliferation potential. Biochem Biophys Res Commun. 2016 Sep 23;478(3):1298-303.
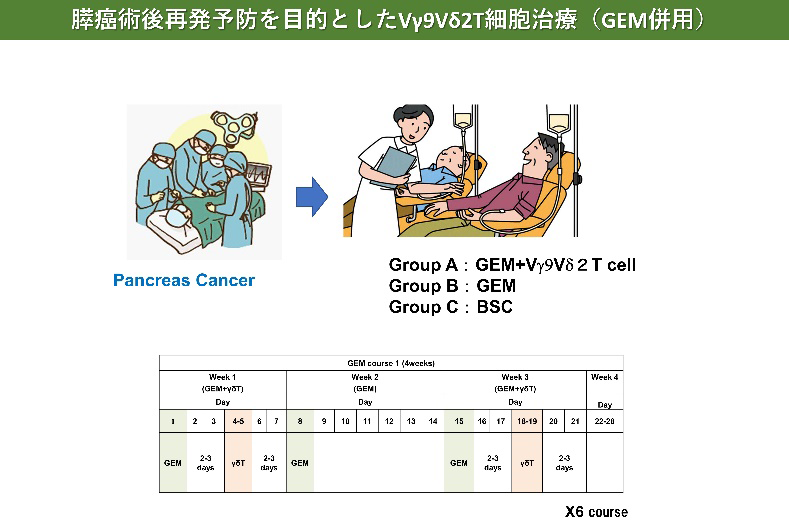
- Aoki T, Matsushita H, Hoshikawa M, Hasegawa K, Kokudo N, Kakimi K. Adjuvant combination therapy with gemcitabine and autologous γδ T-cell transfer in patients with curatively resected pancreatic cancer. Cytotherapy. 2017 Apr;19(4):473-485.
3.3がんワクチン
NY-ESO-1ペプチドワクチン
岡山大学中山睿一教授・大阪大学和田尚教授、川崎医科大学岡三喜男との共同研究でNY-ESO-1抗原を発現する進行・再発、食道・胃・肺および卵巣癌患者(手術不能な病期分類III、IV期、及び術後再発症例)に対してNY-ESO-1fペプチドのOK-432およびモンタナイド(Montanide)併用皮下反復投与における安全性について、有害事象の種類、程度、頻度を評価する臨床試験を行いました。東大病院では、呼吸器外科中島淳教授、胃食道外科瀬戸泰之教授とともに多くの患者さんにワクチンを投与しました。試験を通じて、NY-ESO-1抗原特異的免疫反応誘導効果および抗腫瘍効果について詳細に評価誌多くの論文を発表しました。
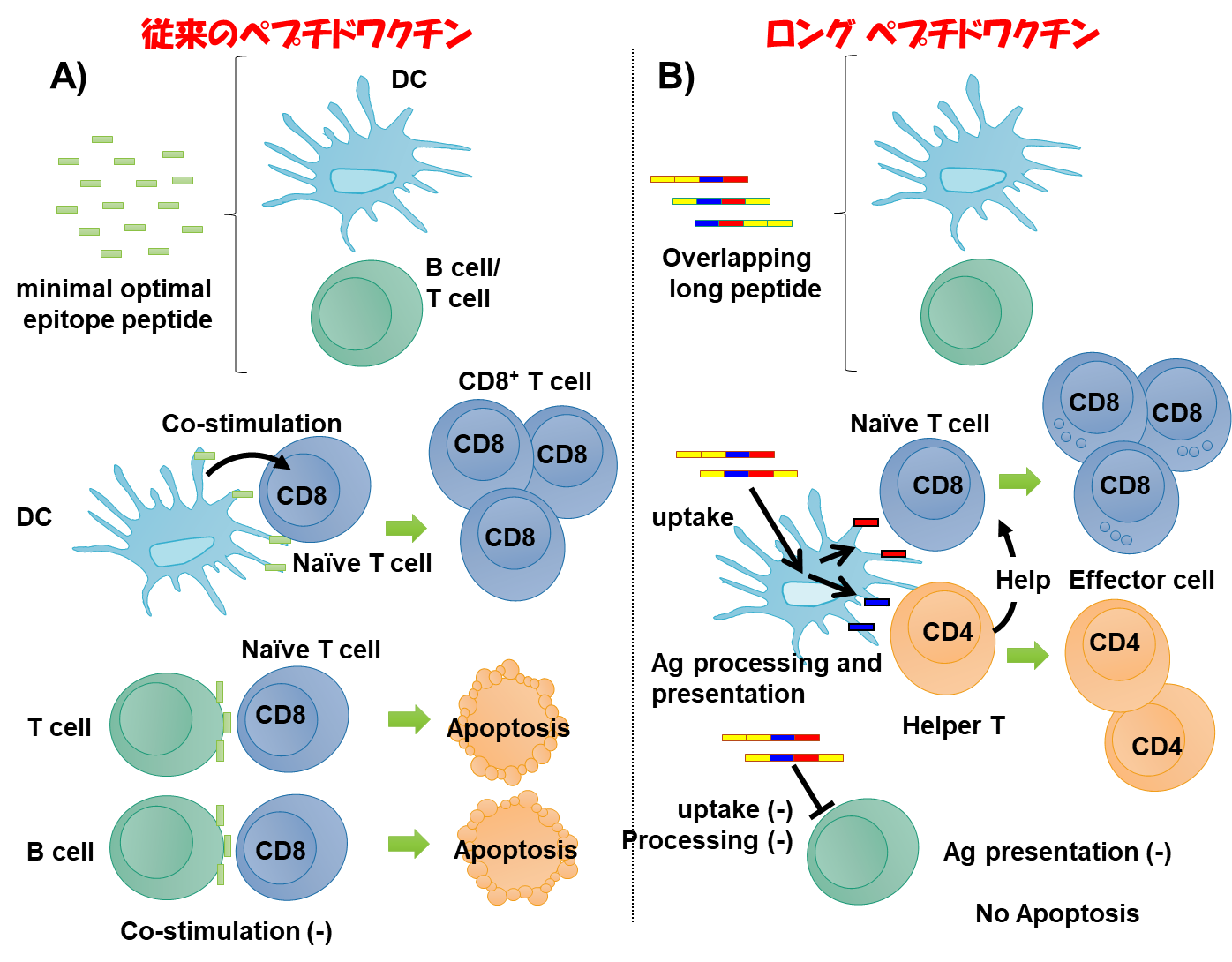
従来のペプチドワクチンでは、ワクチンに反応したT細胞は、ぺプチドに反応するが、がん細胞に反応できない弱点がありました。そこで、私たちは、ロングペプチドワクチンを臨床試験に導入しました。

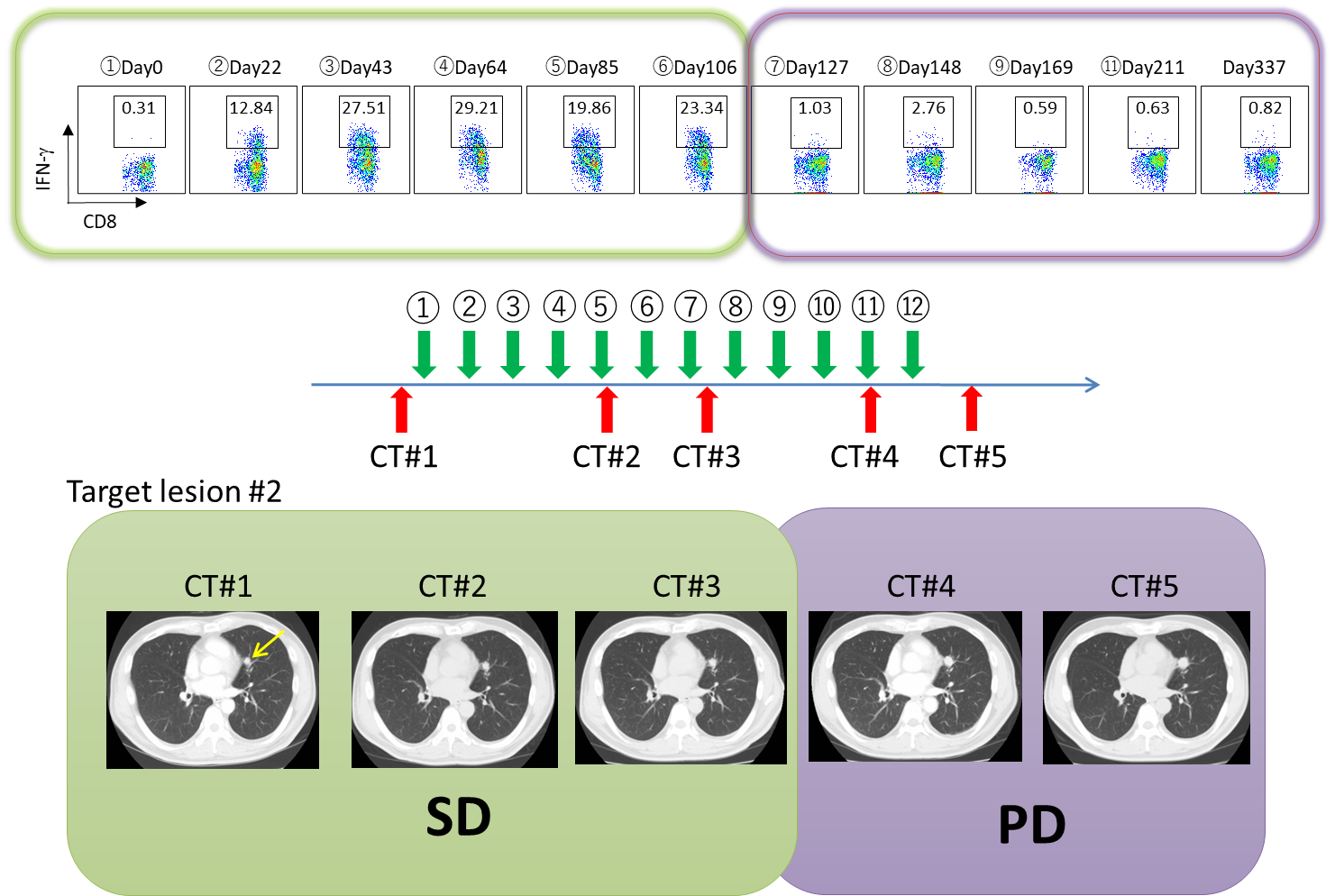
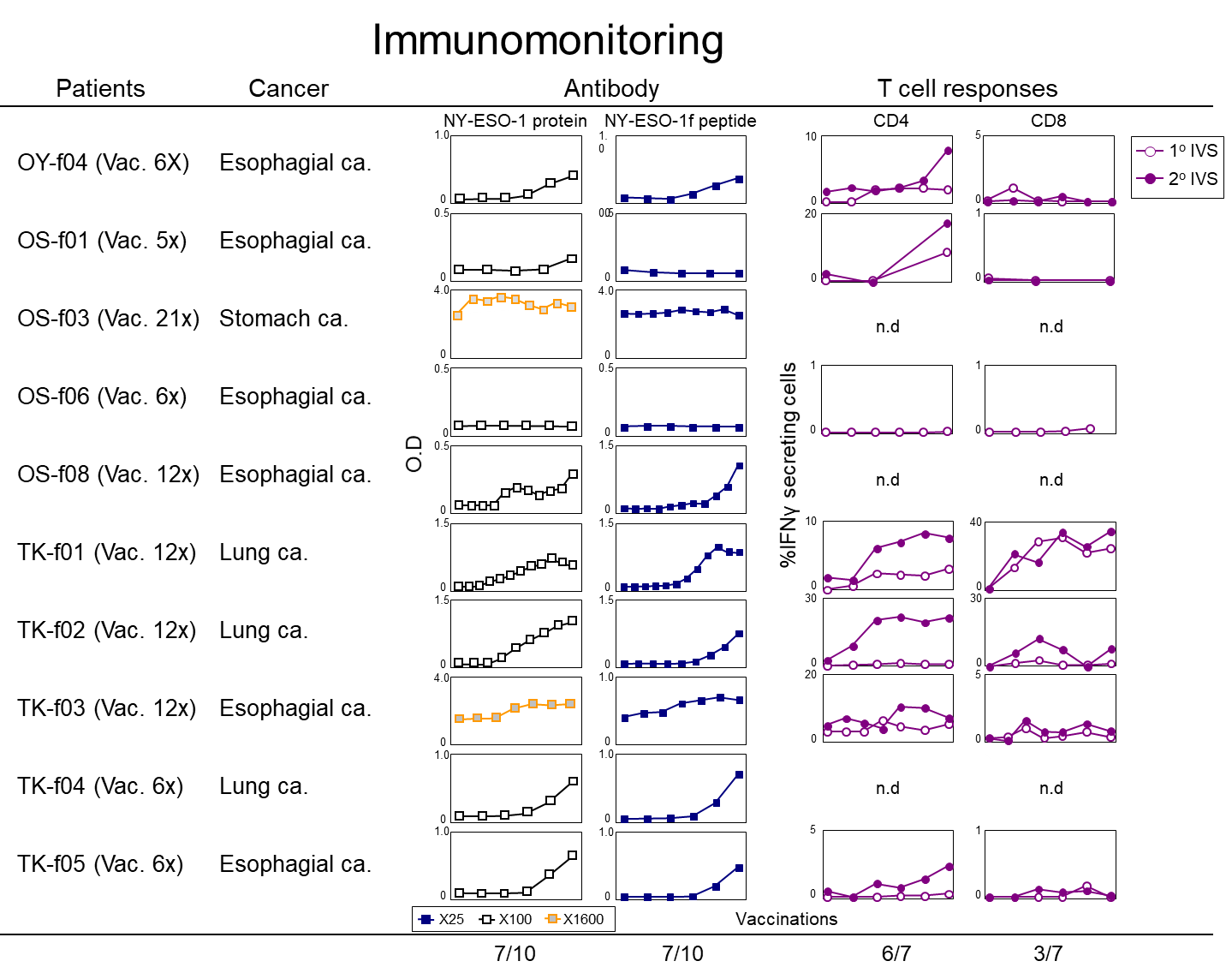
治療経過を詳細に観察し、ワクチンによって誘導されたNY-ESO-1特異的免疫応答の体内動態を経時的に解析し、抗腫瘍効果との関係を検討しました。
- 発表論文
-
- Kakimi K, Isobe M, Uenaka A, Wada H, Sato E, Doki Y, Nakajima J, Seto Y, Yamatsuji T, Naomoto Y, Shiraishi K, Takigawa N, Kiura K, Tsuji K, Iwatsuki K, Oka M, Pan L, Hoffman EW, Old LJ, Nakayama E. A phase I study of vaccination with NY-ESO-1f peptide mixed with Picibanil OK-432 and Montanide ISA-51 in patients with cancers expressing the NY-ESO-1 antigen. Int J Cancer. 2011 Dec 15;129(12):2836-46.
- Eikawa S, Kakimi K, Isobe M, Kuzushima K, Luescher I, Ohue Y, Ikeuchi K, Uenaka A, Nishikawa H, Udono H, Oka M, Nakayama E. Induction of CD8 T-cell responses restricted to multiple HLA class I alleles in a cancer patient by immunization with a 20-mer NY-ESO-1f (NY-ESO-1 91-110) peptide. Int J Cancer. 2013 Jan 15;132(2):345-54.
- Mizote Y, Uenaka A, Isobe M, Wada H, Kakimi K, Saika T, Kita S, Koide Y, Oka M, Nakayama E. Production of NY-ESO-1 peptide/DRB1*08:03 tetramers and ex vivo detection of CD4 T-cell responses in vaccinated cancer patients. Vaccine. 2014 Feb 12;32(8):957-64. doi: 10.1016/j.vaccine.2013.12.042. Epub 2014 Jan 5.
- Wada H, Isobe M, Kakimi K, Mizote Y, Eikawa S, Sato E, Takigawa N, Kiura K, Tsuji K, Iwatsuki K, Yamasaki M, Miyata H, Matsushita H, Udono H, Seto Y, Yamada K, Nishikawa H, Pan L, Venhaus R, Oka M, Doki Y, Nakayama E. Vaccination with NY-ESO-1 overlapping peptides mixed with Picibanil OK-432 and montanide ISA-51 in patients with cancers expressing the NY-ESO-1 antigen. J Immunother. 2014 Feb-Mar;37(2):84-92.
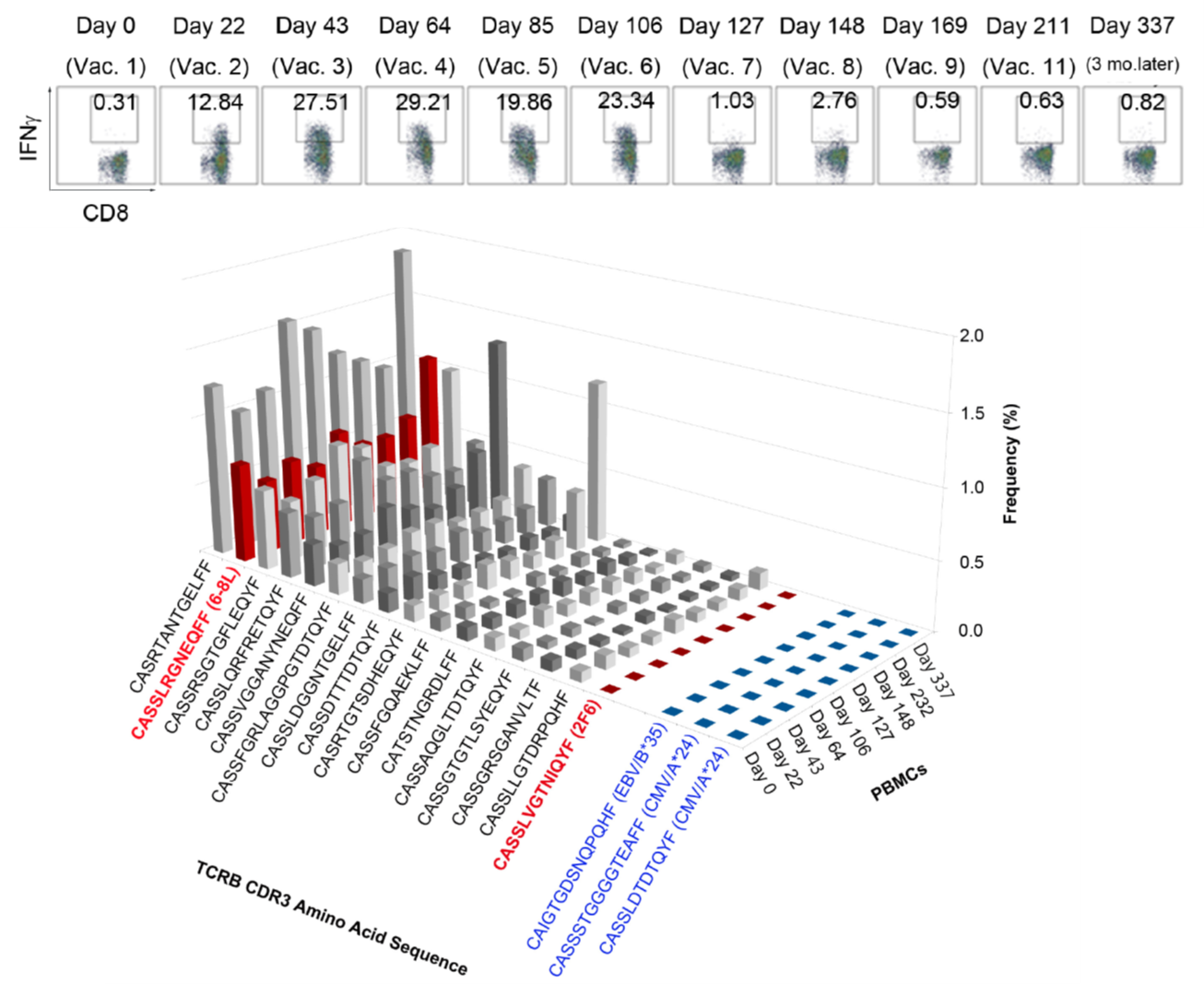
- Miyai M, Eikawa S, Hosoi A, Iino T, Matsushita H, Isobe M, Uenaka A, Udono H, Nakajima J, Nakayama E, Kakimi K. Detection and Tracking of NY-ESO-1-Specific CD8+ T Cells by High-Throughput T Cell Receptor (TCRB) Gene Rearrangements Sequencing in a Peptide-Vaccinated Patient. PLoS One. 2015 Aug 20;10(8):e0136086.
樹状細胞ワクチン
従来のペプチドワクチンは、誘導されたT細胞が、皮下に投与された部位に残存するペプチドに対して反応し、exhaustの状態に陥り、腫瘍内への抗原特異的T細胞浸潤は減弱するという弱点があった。一方、皮下に投与された樹状細胞は、リンパ節へ移動し、強い抗原特異的T細胞を誘導し、活性化されたエフェクター型のT細胞が腫瘍へ浸潤することから、より強力な抗腫瘍効果が誘導されると期待された。
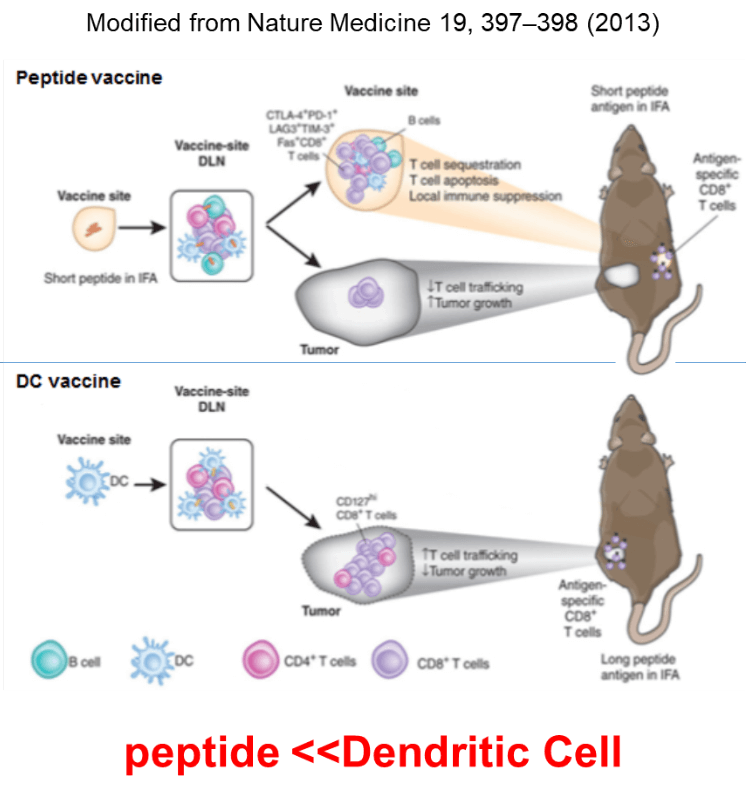
我々は、マウスのモデルを用いて、ペプチドワクチンで誘導された抗原特異的T細胞と樹状細胞ワクチンで誘導されたこうげんとくてきT細胞のNGS解析を行い、分子レベルでの違いを評価した。樹状細胞で誘導した抗原特異的T細胞は、セントラルメモリー型の形質を持ち、増殖脳に優れたT細胞であった。
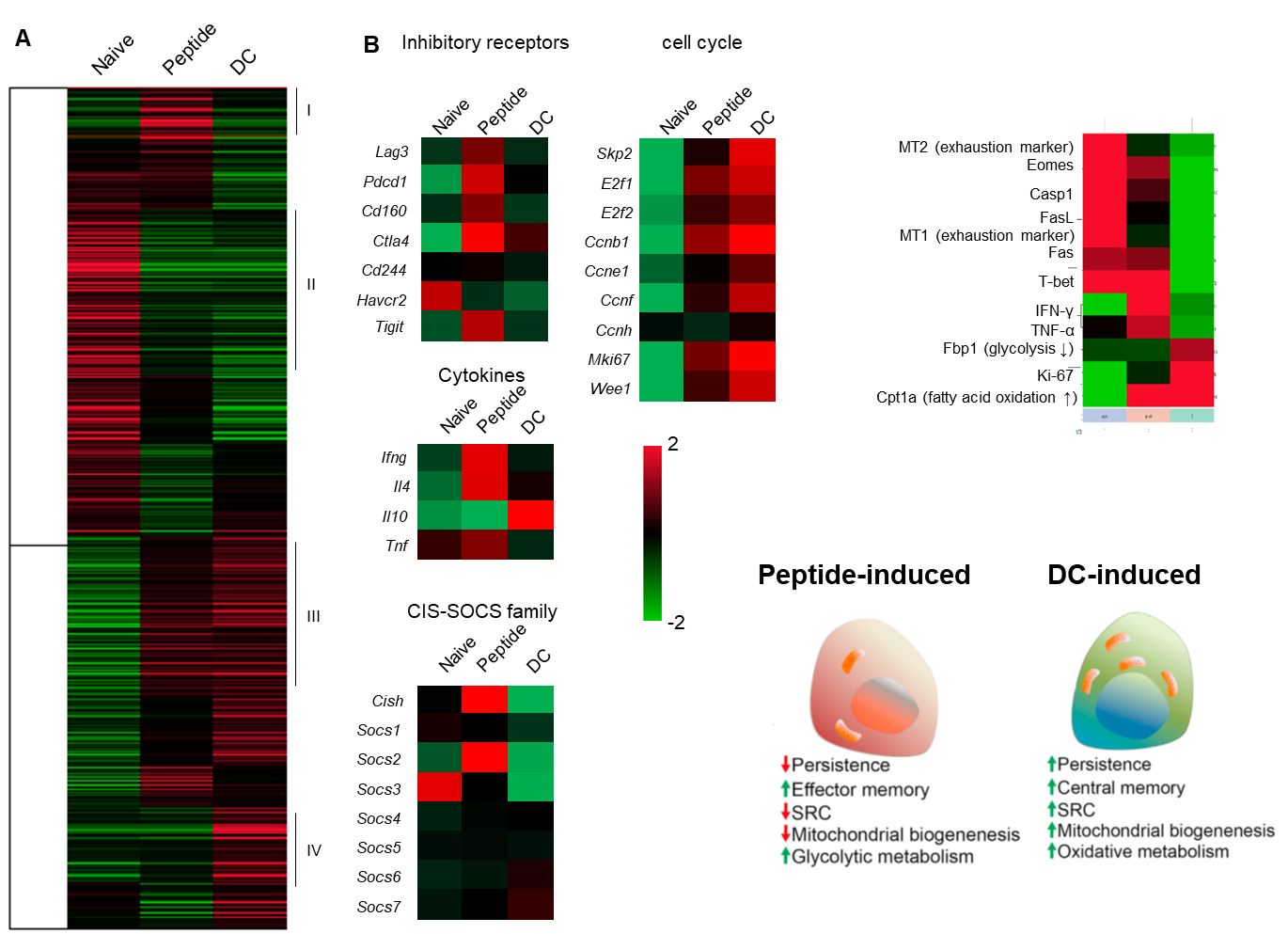
ペプチドワクチンによって誘導されたT細胞は、腫瘍内でPD-1・Tim-3を発現し、exhasutの状態に陥りやすいが、樹状細胞ワクチンで誘導された抗原特異的T細胞はPD-1・Tim-3の発現は3分の1程度に抑えられており、腫瘍内でも活性が持続することが期待された。
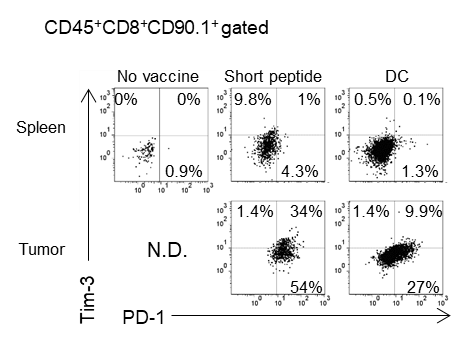
腎細胞がんに対する樹状細胞ワクチン治療
腫瘍特異的T細胞は、腫瘍特異的遺伝子変異産物である変異アミノ酸を含んだタンパク、ネオアンチゲンに反応することが知られていた。当時は、まだ個々の患者の遺伝子変異を同定し、一人一人の患者に合わせてがんワクチンを調製することは不可能であった。そこで、樹状細胞ワクチンで用いる抗原として、我々は腫瘍溶解物(ライセ―ト)に着目した。
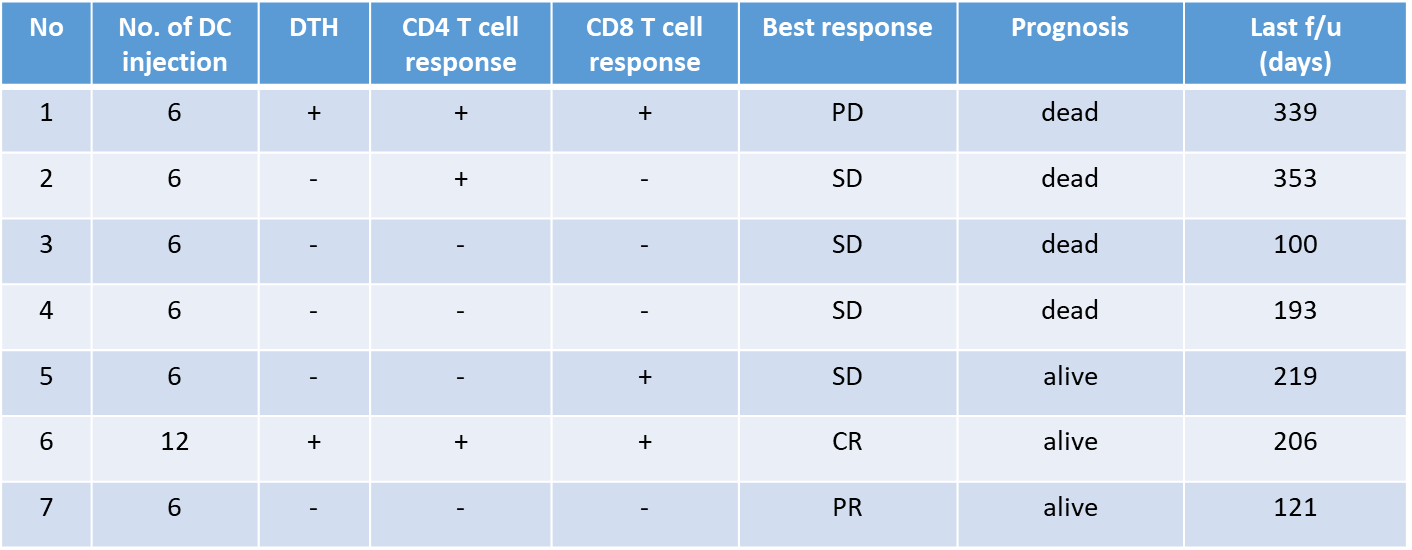
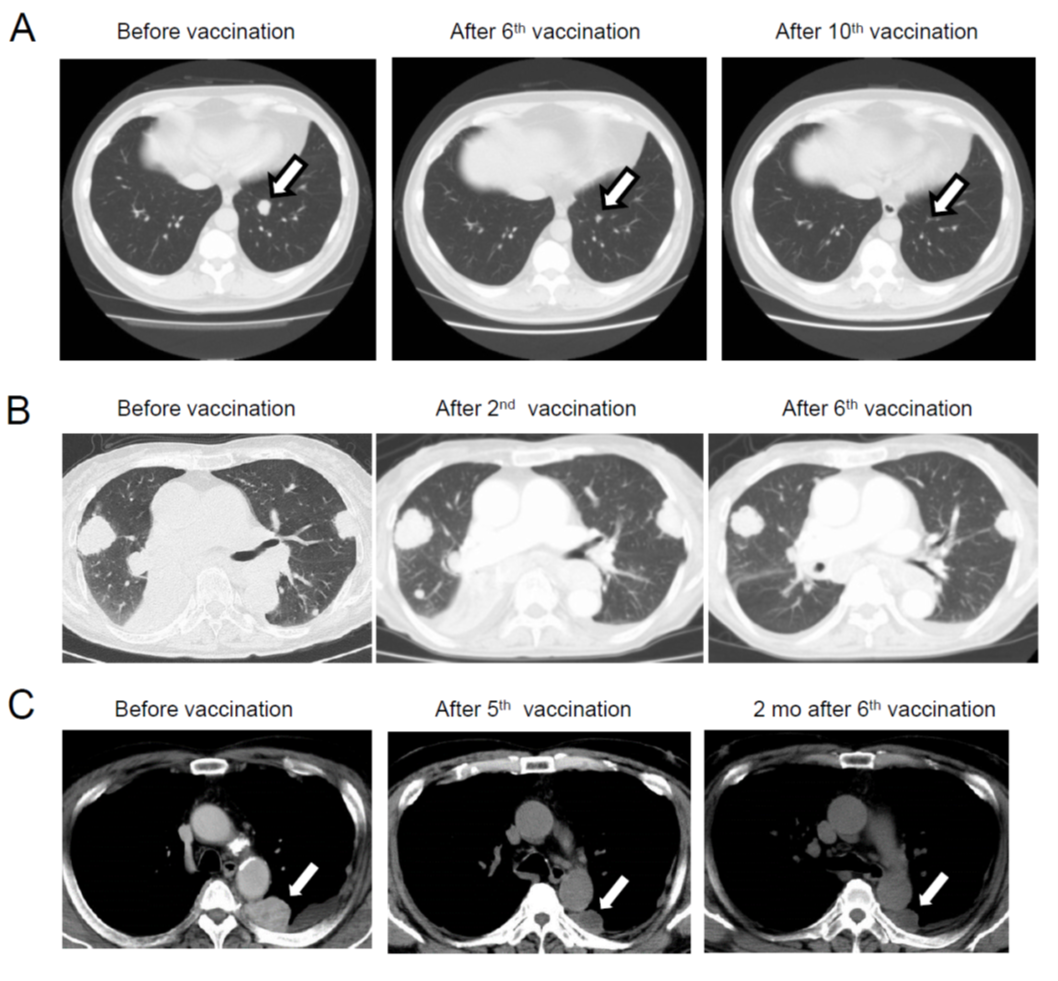
腫瘍内には、当然ネオアンチゲンが含まれており、腫瘍溶解物には複数のネオアンチゲンが含まれている可能性が期待された。そこで、東大病院泌尿器科(当時の本間之男教授、久米春喜准教授(現教授)榎本裕講師(現在三井記念病院)、中川徹講師(現在の帝京大学医学部教授)とともに、腎摘出術を受ける転移性腎がん患者に対して、樹状細胞ワクチンの臨床試験を実施した。転移性腎がん患者は、腎摘出術後の転移巣の治療に分子標的薬のスニチニブの投与を受けることが標準治療として確立していた。スニチニブは、抑制性T細胞(Treg)やMDSCなどの抑制性細胞を減少させることから、樹状細胞ワクチンとの併用で、相乗効果・相加効果が期待された。
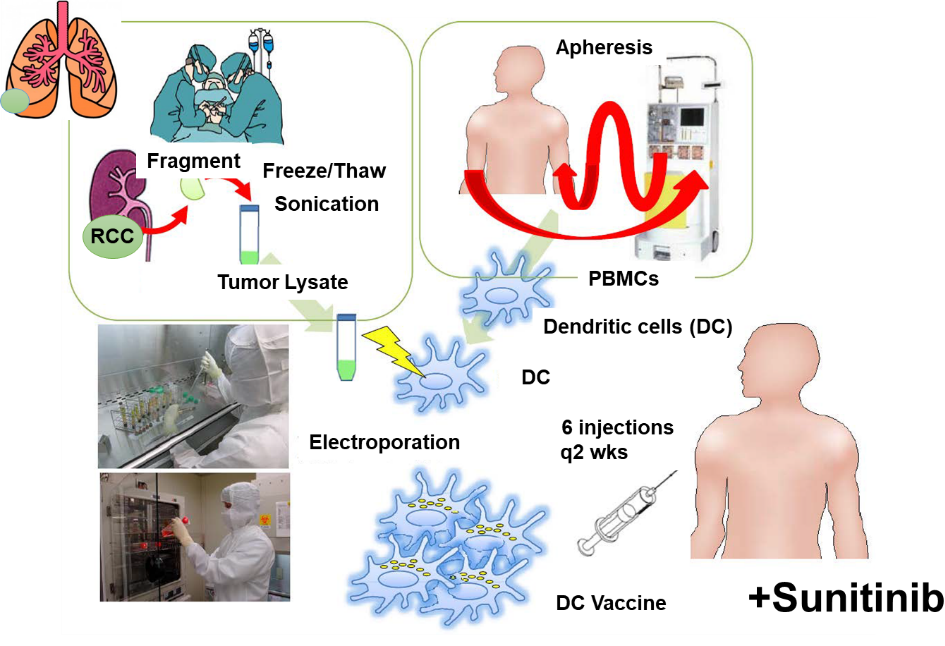
- 治療効果
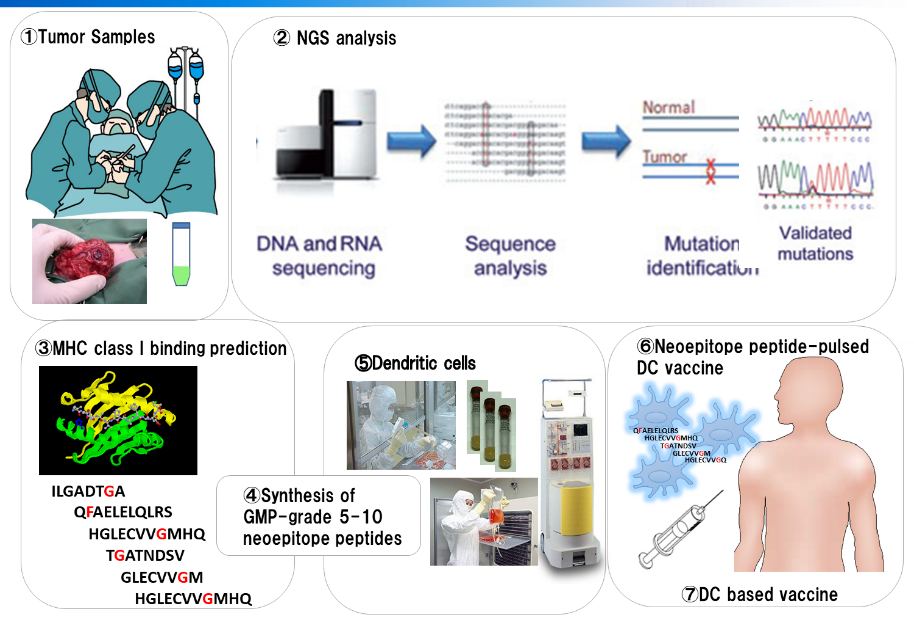
次世代シーケンサー(NGS)により、個々の患者の腫瘍において、遺伝子変異を同定しネオアンチゲンが予測できるようになったことから、今後はネオアンチゲンを用いた樹状細胞ワクチン治療を開発していきたい。また、免疫チェックポイント阻害剤との併用や、TCR-T細胞治療などの併用など、最新の免疫制御技術を組み込んで、より効果的ながん免疫治療の開発に貢献したい。
- 発表論文
-
- Nagaoka K, Hosoi A, Iino T, Morishita Y, Matsushita H, Kakimi K. Dendritic cell vaccine induces antigen-specific CD8+ T cells that are metabolically distinct from those of peptide vaccine and is well-combined with PD-1 checkpoint blockade. Oncoimmunology. 2017 Nov 20;7(3):e1395124.
- Matsushita H, Enomoto Y, Kume H, Nakagawa T, Fukuhara H, Suzuki M, Fujimura T, Homma Y, Kakimi K. A pilot study of autologous tumor lysate-loaded dendritic cell vaccination combined with sunitinib for metastatic renal cell carcinoma. J Immunother Cancer. 2014 Aug 19;2:30.