Tumor
Immunity腫瘍免疫の基礎知識(垣見の腫瘍免疫学)
免疫細胞治療学講座で実施している研究のベースとなる腫瘍免疫に関する基礎知識、考え方を概説します。
9.複合的がん免疫治療
臨床試験において優れた成績が示され、次々と適応が拡大されている免疫チェックポイント阻害剤だが、それでも単剤での効果は限定的である。奏効率を改善すべく、様々な組み合わせによる複合がん免疫療法に対する臨床試験が世界中で始められている。最適な複合がん免疫療法を行うためには、免疫のメカニズムとダイナミックな抗腫瘍免疫応答に対する理解が重要である。そしてどのような患者に対し、どのような組み合わせの治療が役立つのかを判定するために、既存の枠にとらわれない新たなバイオマーカーの創出が求められている。
生体が持つ免疫の働きを積極的にがん治療に結び付けようとする試みが、がん免疫療法である。抑制されていた抗腫瘍免疫応答を再活性化し細胞性免疫応答を増強するのが「チェックポイント阻害剤」であるが、従来の抗がん剤に対して抵抗性を示した非小細胞肺がんやメラノーマ患者の一部において奏功したことは、生体における抗腫瘍免疫応答が腫瘍の増殖を制御可能であることを広く認識させた。一方で、単剤での奏効率まだ決して高いとは言えず、効果は限定的である。肺がん患者における奏効率はせいぜい20-30%程度であり、予後改善効果は数か月程度に過ぎない。そこで、がん免疫療法の効果をより高く発揮するために、作用の異なる治療法を併用する複合がん免疫療法が期待されている。
化学療法等との併用の根拠
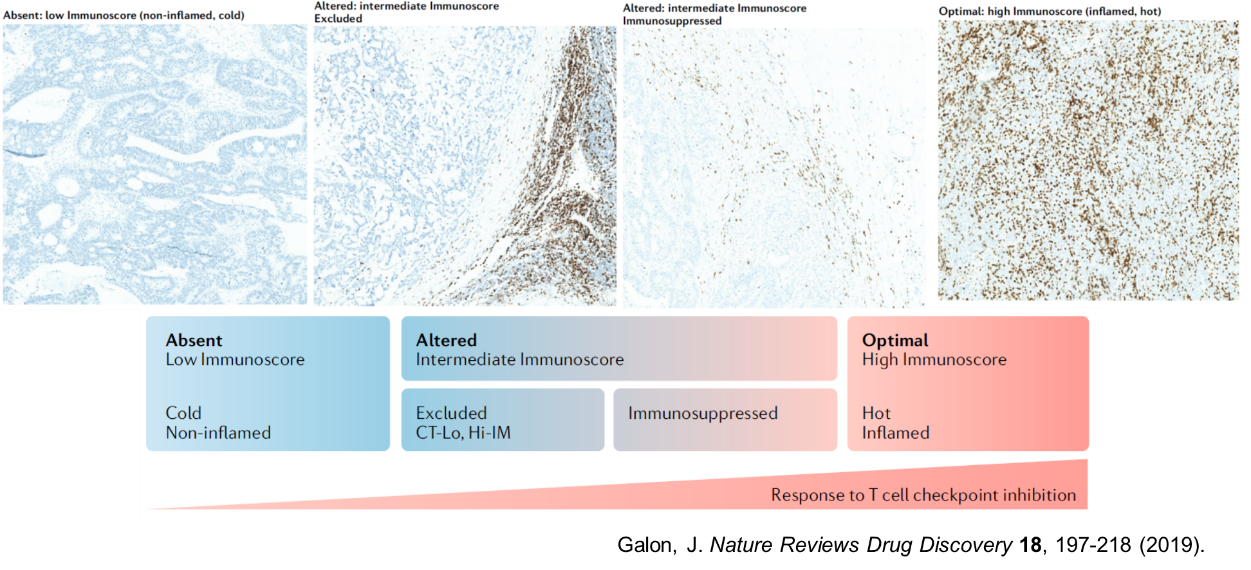
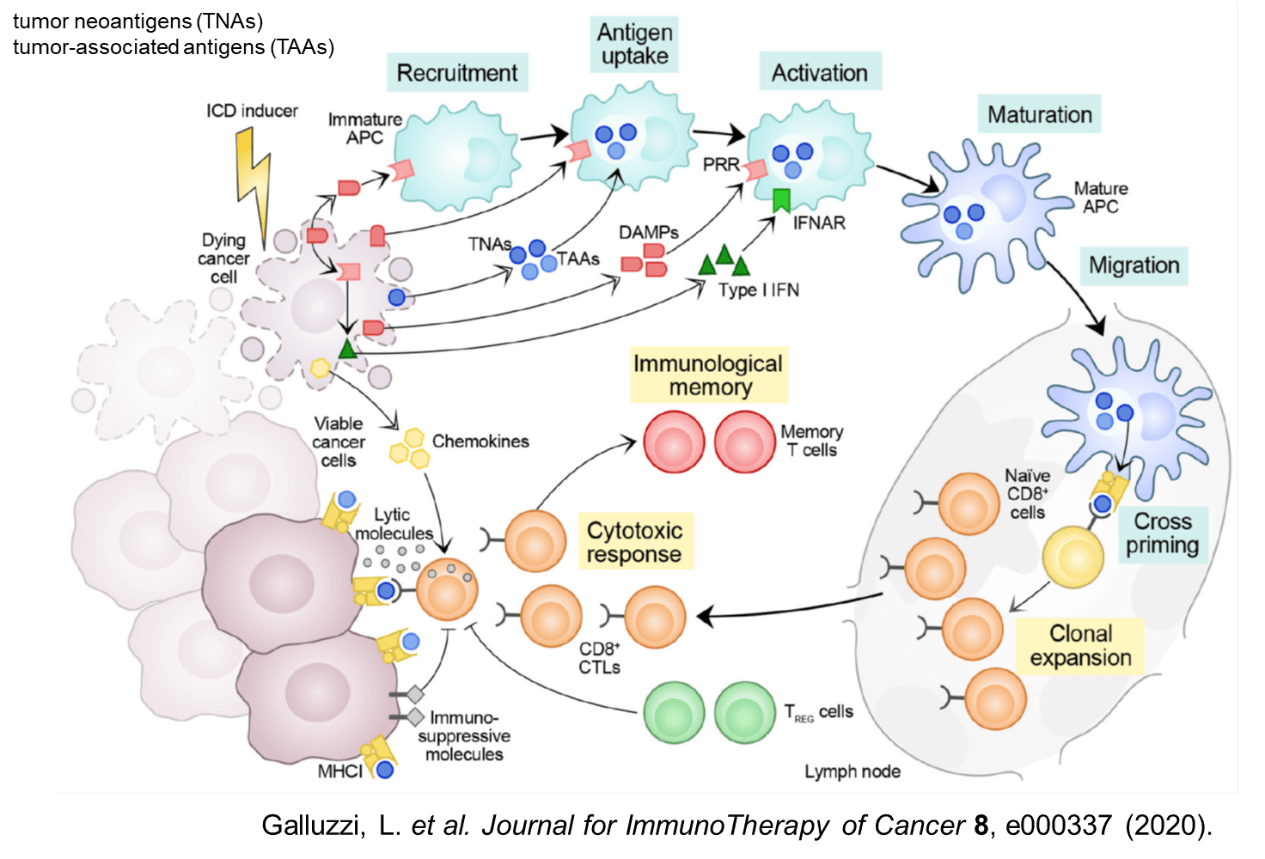
化学療法による細胞死の誘導には、免疫応答の誘導につながるImmunogenic cell deathの存在が知られている。免疫チェックポイント阻害剤が無効である、腫瘍内に免疫細胞浸潤が認められない、いわゆるCold tumorに対して、化学療法との併用が期待されている。化学療法によるがん細胞死により、がん細胞からネオアンチゲンなどのがん抗原が放出される、DAMP(damage associated molecular pattern)と呼ばれるデンジャーシグナルは、樹状細胞を活性化させ、抗原提示能力を高めてT細胞免疫応答の誘導に優位に働く。細胞死に伴いケモカインやサイトカインが産生され、腫瘍内への細胞浸潤が促進される。
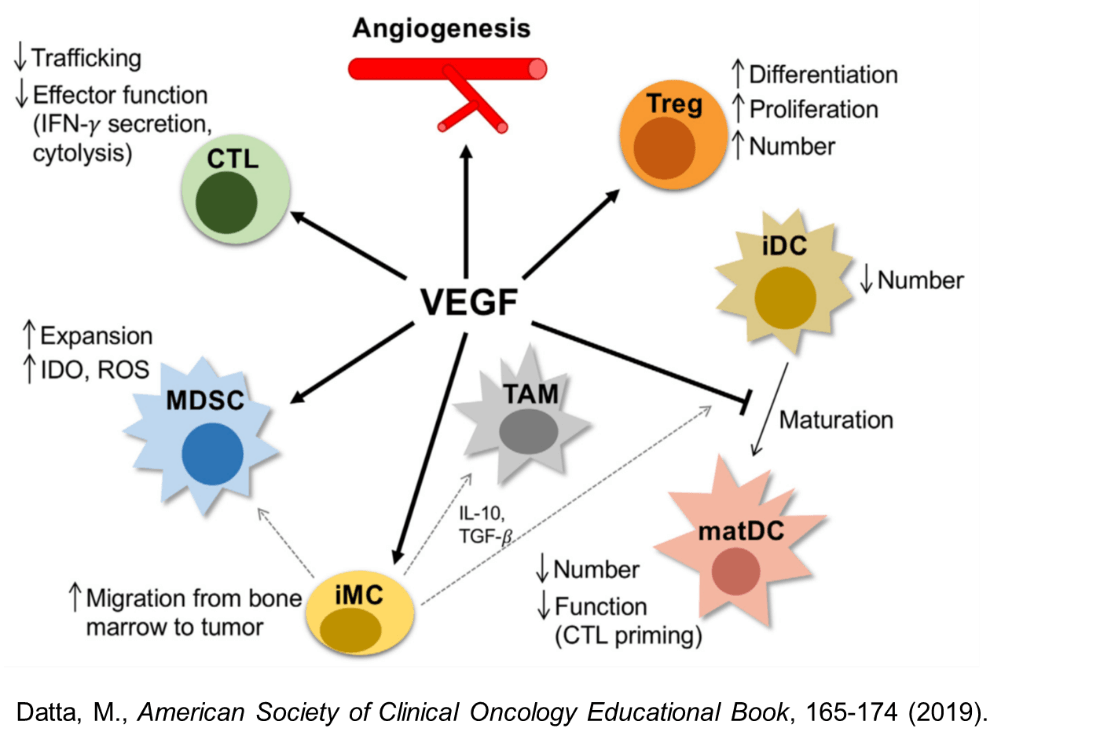
VEGFは、血管新生のみならず、幅広く免疫抑制性の環境の形成にかかわることが知られている。VEGFは、Tregの分化や増殖を促進し、樹状細胞の成熟を抑制する。MDSCの増殖を促進するのみならず、IDOやROSなどの免疫抑制物質の産生を増強させる。また、CTLの腫瘍内への浸潤やそのエフェクター機能を抑制することが知られている。血管新生阻害剤である抗VEGF治療薬には、これらの免疫抑制活性を制御することで、抗腫瘍免疫応答を促進する作用が期待される。
従来の抗がん剤にも、細胞傷害作用に加えて、様々な機序で免疫を活性化する作用を備えていることが明らかになってきた。低用量のシクロホスミドはTregやMDSCを除去することで免疫を活性化する。パクリタキセルやシスプラチン、ドキソルビシンは、腫瘍細胞の感受性を高めて、免疫細胞の攻撃によるアポトーシスの誘導を促進する。パクリタキセルはマクロファージからの炎症性サイトカイン産生を促し、DC、NK細胞、T細胞の活性化を誘導する。アントラサイクリン、オキザリプラチン等は、細胞表面へのカルレティキュリンの発現、HMGB1やATPの放出を介して、抗原提示細胞を活性化し、T細胞応答を誘導する。
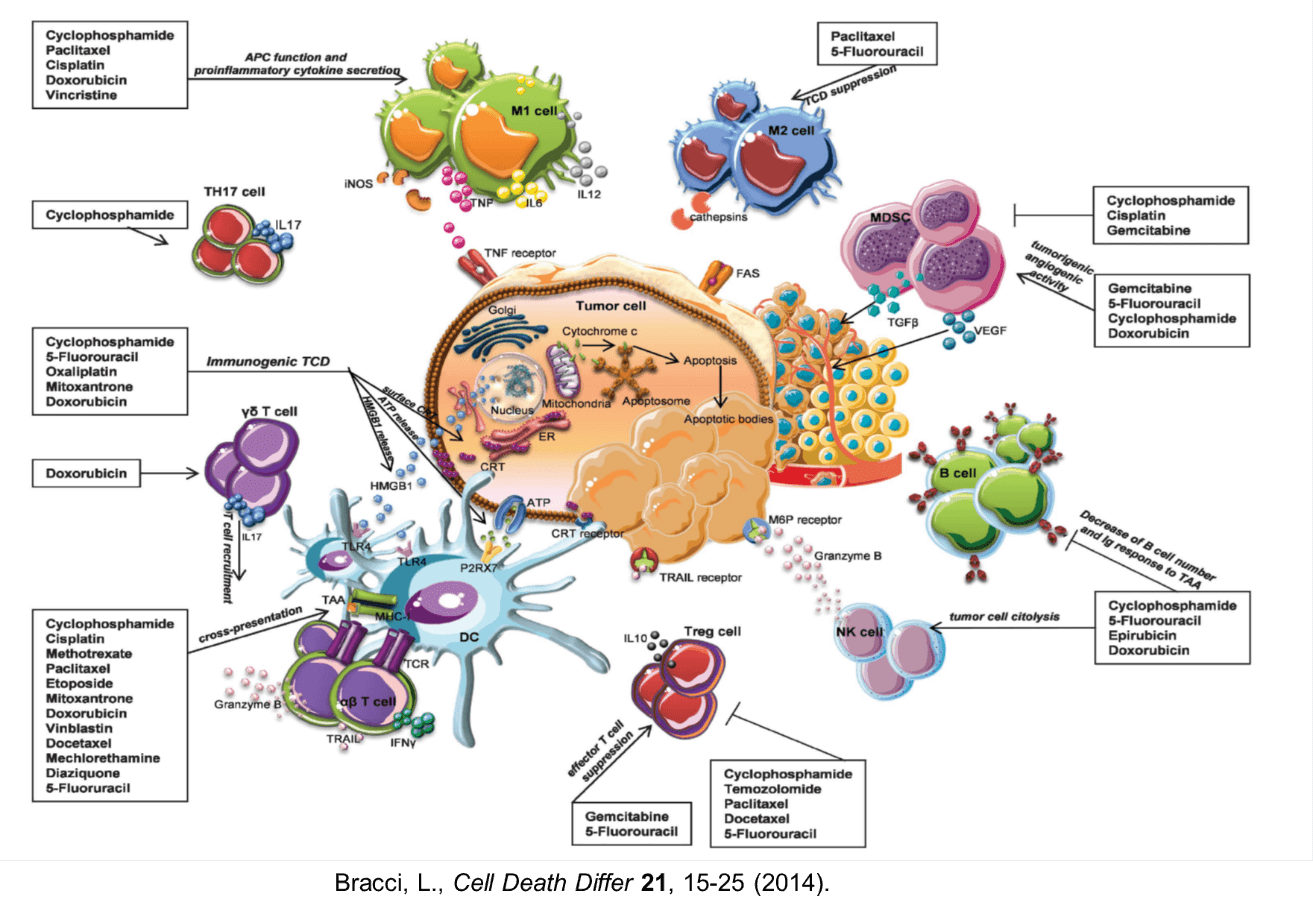
化学療法の併用は、1)がん抗原の放出、2)抗原提示細胞の活性化、3)がん細胞の抗原提示の増強、4)免疫抑制性の細胞の制御、5)腫瘍内への浸潤、6)腫瘍反応性T細胞の増殖、7)腫瘍反応性T細胞の機能の増強、などの多彩なメカニズムで抗腫瘍免疫応答を活性化することが期待されるが、各併用薬の投与量・投与のタイミング、適切な組み合わせなどの最適化を検討する必要がある。