Tumor
Immunity腫瘍免疫の基礎知識(垣見の腫瘍免疫学)
免疫細胞治療学講座で実施している研究のベースとなる腫瘍免疫に関する基礎知識、考え方を概説します。
4.抗腫瘍免疫応答の成立・誘導
4.1.時間と空間
がん抗原やネオアンチゲンを同定できれば、次はそれに対する強力な免疫応答を誘導し、治療に役立てることが可能になる。よし、これでがんワクチンを作ろう!腫瘍特異的キラー細胞を増殖させて治療しよう!と単純にはいかない。
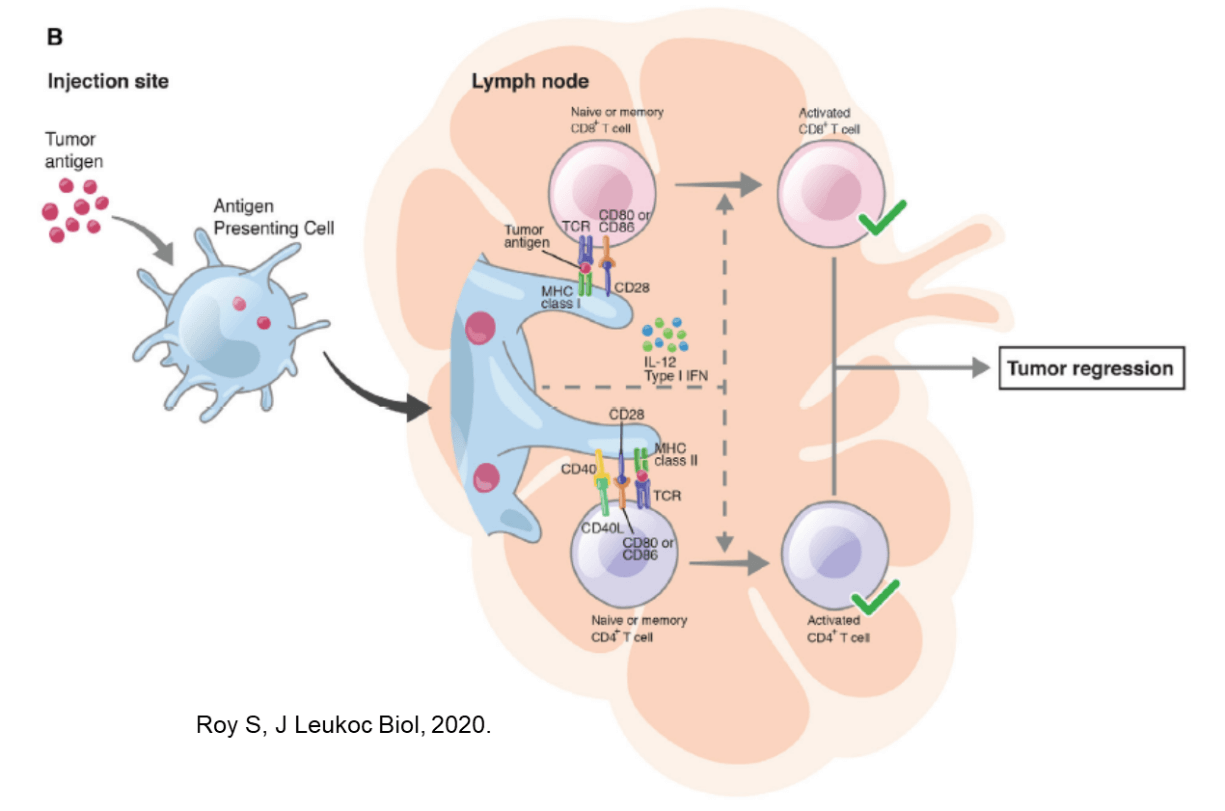
がんワクチンを投与すると、それはまず樹状細胞などの抗原提示細胞に取り込まれ、リンパ節に移動した樹状細胞とそこに存在するCD4+T細胞やCD8+T細胞との相互作用により、抗原特異的なT細胞が選択的に刺激活性化され、免疫応答を開始する。ここでは、レセプターとリガンドの分子レベルの制御が重要である。また、抑制性の作用を持った細胞も複雑に関係する。正と負の制御を受けた後、腫瘍特異的T細胞はリンパ節を出て、腫瘍局所に到達し、がん細胞を検出して攻撃すると期待されるが、ここでも、腫瘍が形成する免疫環境下の影響を強く受ける。T細胞は、刺激を受けて、分化の段階が進むとともに、新しい機能を得て場所を移動する。多くの細胞や分子がかかわっており、その反応が場所を変えて経時的に進行するため非常に複雑である。そこで、まず「時間」と「空間」をキーワードに腫瘍免疫を考えてみたい。
4.2.がん免疫サイクル
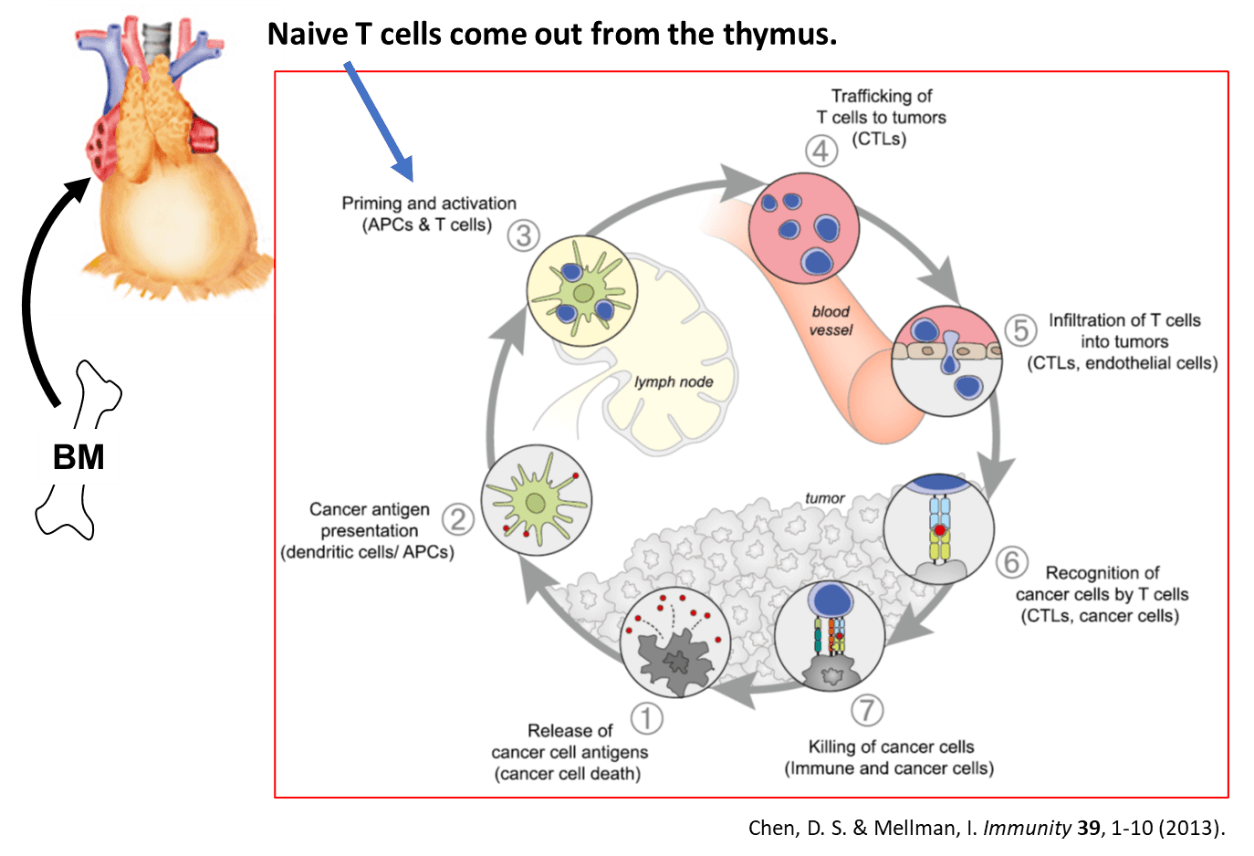
がん免疫サイクルは、図に示したように7つのステップからなる(Chen, D. S. & Mellman, I. Immunity 39, 1-10 (2013))。腫瘍内で細胞死などに陥ったがん細胞からがん抗原が放出され(ステップ1)、それを樹状細胞(DC)が取り込み、成熟化すると同時にリンパ節へと遊走する(ステップ2)。リンパ節でDCは取り込んだがん抗原を主要組織適合遺伝子複合体(Major histocompatibility complex、MHC)クラスI分子に提示することにより、T細胞をプライミングし(ステップ3)、活性化したT細胞は腫瘍へ遊走する(ステップ4)。活性化T細胞は腫瘍組織へ浸潤し(ステップ5)、がん細胞を認識(ステップ6)、傷害する(ステップ7)。ステップ7でT細胞が傷害したがん細胞から新たながん抗原が放出され再びステップ1へと進むため、がん免疫サイクルは回り続ける。多くのがん患者では、これらの一連のステップのうち、ひとつまたは複数で障害が生じており、効果的ながん免疫応答が誘導されなくなってしまっている。
骨髄から胸腺を経てリンパ節に到達したT細胞は、ステップ3からこのがん免疫サイクルに組み込まれることになる。
がん免疫サイクルを正に制御する因子を図に緑文字で示した。ステップ1ではがん細胞の発現するネオアンチゲンやがん精巣抗原の数が多いとより多くの種類のがん抗原特異的T細胞が誘導可能になると考えられる。また、がん細胞が、ネクローシスなどのimmunogenic cell deathを起こすと、抗原と同時に放出されるHMGB1がDC上のToll様受容体(Toll-like receptor、TLR)2やTLR4に作用して、DCの成熟化が誘導されるので効率よく抗腫瘍免疫が誘導される。ステップ2に関しては、DCによるCCR7の発現がリンパ節への遊走を誘導し、CD40/CD40Lシグナルや、TLRリガンドなどはDCの成熟化をもたらす。また腫瘍内に存在するDCサブセットのうち、cDC1が多いと予後が良いことが報告されている。cDC1は腫瘍内でがん抗原を取り込み、リンパ節へ遊走してCD8+T細胞をクロスプライミングすることが知られている。また腫瘍内のナチュラルキラー(Natural killer、NK)細胞がXCL1やCCL5などのケモカインやFLT3リガンドを産生しcDC1を誘引する。ステップ4では、腫瘍や腫瘍内環境におけるCXCL9、10、CCL5などのケモカイン発現がT細胞の遊走をより強く誘導する。ステップ5では、T細胞の発現するLFA1と血管内皮上のICAM-1の相互作用が、T細胞の腫瘍内浸潤を活性化させる。ステップ7では、T細胞やNK細胞が産生するインターフェロン-γ(IFN-γ)が腫瘍細胞の細胞増殖を抑制し、MHCクラスI抗原提示経路を増強する。また、腫瘍関連マクロファージ(TAM)のうちM1型のものが、抗腫瘍免疫を促進する。
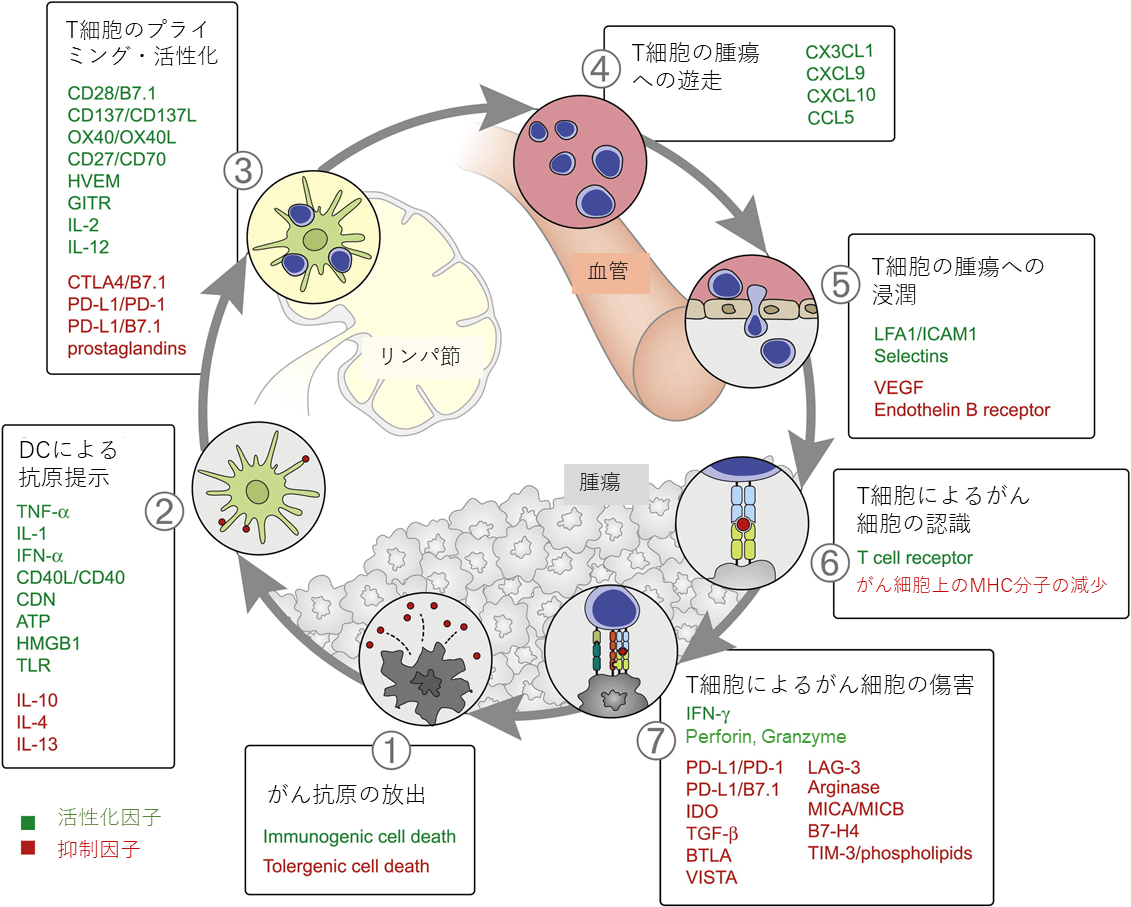
がん免疫サイクルを負に制御する因子を図に赤文字で示した。がん免疫サイクルの進行の障害となる細胞や分子は数多く存在する。ステップ1では、がん細胞がアポトーシスなどトレランスを誘導する細胞死を起こした場合には、抗腫瘍免疫応答は抑制される。リンパ節の制御性T細胞がCTLA-4とDC上のCD80、CD86と相互作用して、T細胞プライミングを抑制する(ステップ3の障害)。ステップ5では、がん細胞の産生するVEGFがT細胞の腫瘍内への浸潤を抑制する。またβカテニンシグナルが活性化しているがん細胞は、CCL4産生が低く、CXCL10を産生するcDC1の腫瘍への集積が抑制されるため、結果として腫瘍内へのT細胞浸潤が少ない(ステップ2、5の障害)。またがん細胞におけるPTENの欠失も腫瘍内へのT細胞浸潤を抑制する(ステップ5の障害)。ステップ6ではがん細胞のMHCクラスI抗原提示経路に関わるTAPやB2Mが欠損すると、がん細胞はT細胞による認識から逃れてしまう。ステップ7では、T細胞に発現されるPD-1、がん細胞に発現されるPD-L1をはじめとする免疫チェックポイント分子が重要な因子である。加えて、がんの周囲の微小環境にも影響を受ける。腫瘍内に存在する骨髄由来抑制細胞(Myeloid-derived suppressor cell、MDSC)や制御性T細胞は抗腫瘍免疫応答を抑制する。腫瘍関連線維芽細胞(Cancer-associated fibroblast、CAF)は、腫瘍内微小環境の細胞外マトリックスを再構築することにより、免疫抑制環境を作り出す。またM2型のTAMは免疫抑制に働くことが知られている。
4.3.Adaptive Resistance:Counter Regulation
がん免疫サイクルの障害を生み出すメカニズムのひとつとして、adaptive resistanceが挙げられる。免疫系は感染した病原体に対して免疫応答を起こすが、同時に過剰な免疫応答による組織傷害を防ぐためのネガティブフィードバック機構を持っている。がんはこのネガティブフィードバック機構を利用してがん免疫サイクルの障害を作り出している。例えば、腫瘍内T細胞が腫瘍に反応して産生したIFN-γががん細胞や腫瘍内浸潤細胞に作用して、PD-L1やIDOなどの抑制性分子の発現を誘導することにより、がん免疫サイクルが障害される。
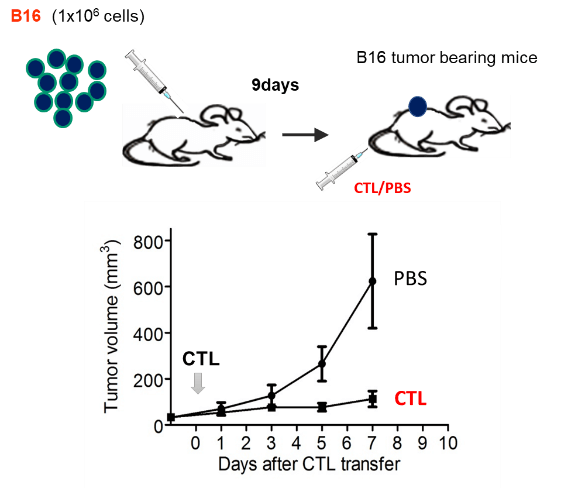
マウスのCTL治療モデルでは、B16メラノーマ細胞の担癌マウスに対し、メラノーマ特異的CTLを投与すると、腫瘍の増殖が抑制される。CTLは、投与後day 1から腫瘍内に検出されるが、day 3, day 5と次第に数を増し、day 5に反応のピークを迎えた。その後腫瘍内のCTLは数は減らすもののday 17でも腫瘍内にCTLは検出された。
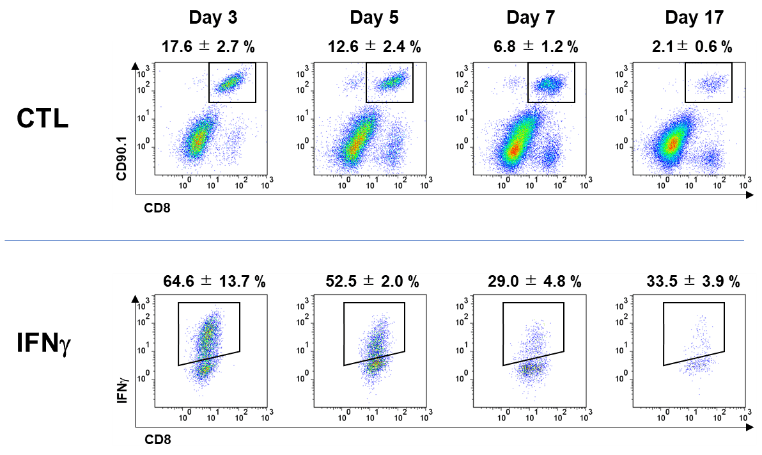
腫瘍内に浸潤したCTLのIFN-γ産生能を見たところ、day3, day 5のCTLは64.6%、52.5%のCTLがIFN-γを産生したが、day 7やday17のCTLは29.0%、33.5%のCTLしかIFN-γを産生することができなかった。腫瘍内でCTLは次第にその機能を喪失していた。
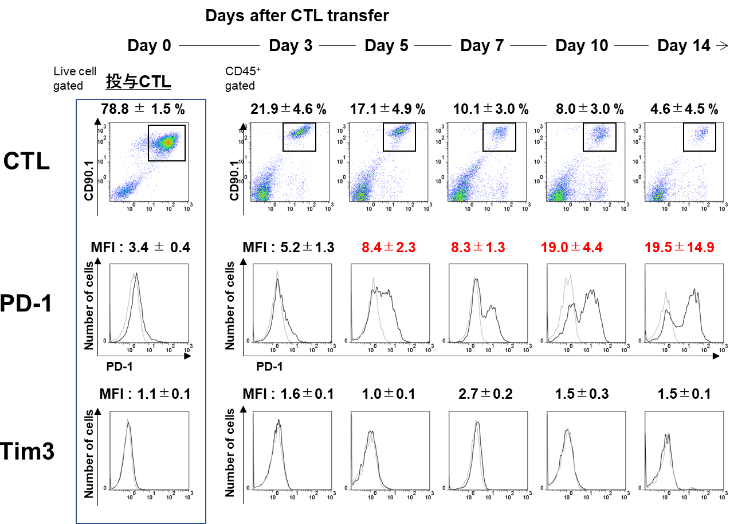
腫瘍内浸潤CTLのPD-1とTim-3の発現を見ると、投与したCTLのPD-1発現のMFI値は3.4であったが、腫瘍内でday 5には、8.4、day 10には、19.0、day 14には19.5とPD-1の発現が著明に更新していた。
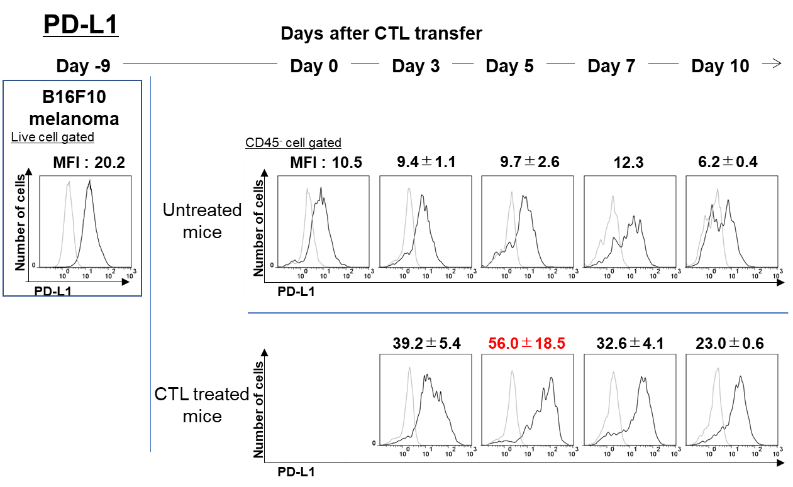
一方PD―L1を発現しているがん細胞は、CTLの浸潤がない場合は、PD-L1のMFI値約10程度であったが、CTLが腫瘍内に浸潤し、がん細胞を認識してIFN-γを放出すると、IFN-γによってMFI値はday 3に39.2、day 5に56.0とPD-L1の誘導が増強していた。CTLからのIFN-γ産生が減弱するday 7、day 14では、PD-L1の発現も32.6、23.0と減弱していた。
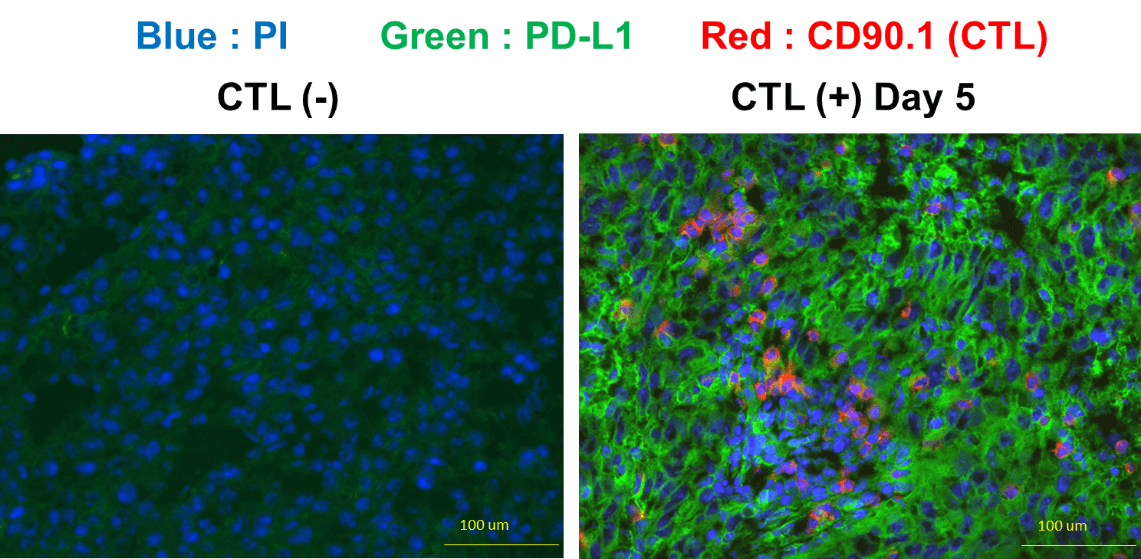
PD-1/PD-L1系による免疫抑制だけでなく、CTL治療を受けた腫瘍内には、CTLの浸潤に伴い、Myeloid-derived Suppressor Cell (MDSC)が誘導されていた。
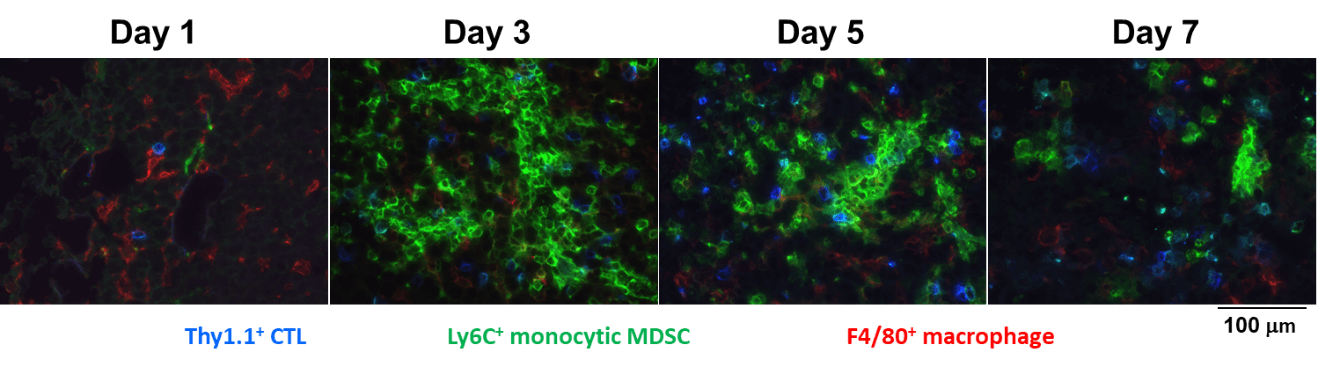
「腫瘍に対する免疫応答が、免疫を抑制する」Counter-regulation, Adaptive resistanceを理解して、これを適切に制御することが、がん免疫治療に必要であり、それにより、有害事象をできるだけ抑えて抗腫瘍効果を増強することが可能なると考えられる。