Tumor
Immunity腫瘍免疫の基礎知識(垣見の腫瘍免疫学)
免疫細胞治療学講座で実施している研究のベースとなる腫瘍免疫に関する基礎知識、考え方を概説します。
8.抗腫瘍免疫応答の統合的解析
免疫チェックポイント阻害剤が様々ながん種において承認されているが、多くの患者はいまだにこれらの治療法に反応しないか、治療効果が認められても後に耐性になる。免疫チェックポイント阻害剤の適応を合理的に判断し、また治療抵抗性のポイントを明らかにするためには、個々の患者において、免疫チェックポイント阻害剤に対する反応性を決定する分子メカニズムを明らかにすることが必要である。これまで蓄積された臨床経験から、腫瘍固有の因子、免疫を含めた腫瘍の微小環境、宿主に関連する因子、そして治療に伴う動的な変化など、免疫チェックポイント阻害剤に対する反応性を規定する因子に関する情報が次第に蓄積されてきた。さらにシングルセルレベルでの高次解析が可能になり、詳細かつ膨大な情報を包括し、それらを統合して効果を予測し、治療抵抗性を克服する鍵を探索することが可能であり必要になってきた。免疫チェックポイント阻害剤治療において、単一のバイオマーカーから、統合的バイオマーカーの時代へと突入しつつある。
8.1.がん免疫にかかわる因子とバイオマーカー
がんの多様性と免疫の多様性の相互作用によって形成される複雑でダイナミックな抗腫瘍免疫応答に対して、単一のバイオマーカーでがん免疫治療の効果予測は困難である。また、がん免疫治療も、単独治療から、抗がん剤、分子標的薬、放射線治療などとの併用治療へと変貌を遂げている、免疫に関するパラメーターのみならず、腫瘍の増殖に直接・間接的にかかわる因子を含めて、より広範な情報を統合する必要がある。
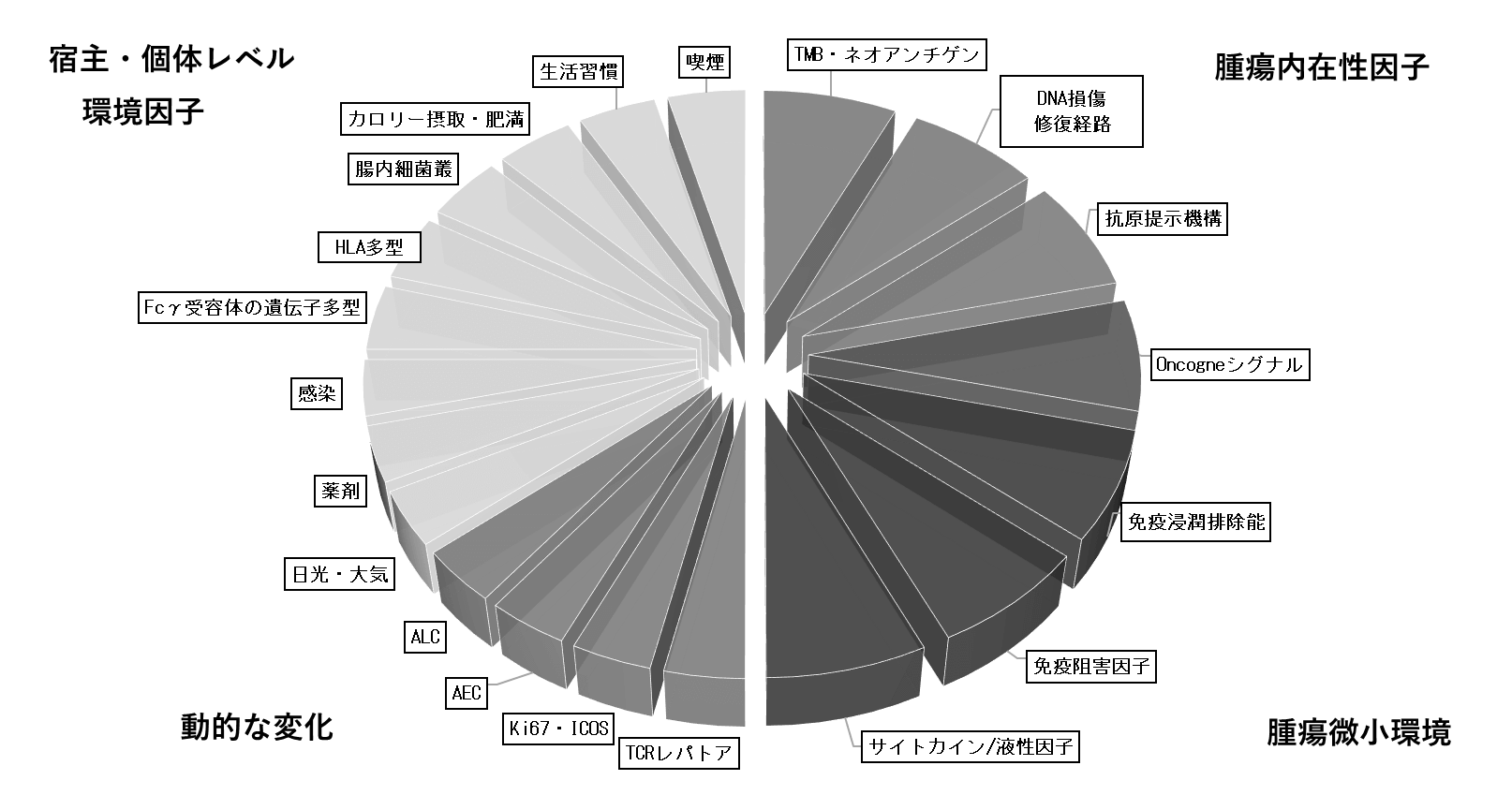
1)腫瘍内在性因子
免疫チェックポイント阻害剤により再活性化したT細胞は、がん細胞表面に提示されたペプチドMHCクラスI分子複合体を認識し、攻撃することで、抗腫瘍効果を発揮すると考えられる。そのため、腫瘍自身の免疫原性が治療効果に深く関与している。正常細胞に存在しないアミノ酸配列を持ったペプチドを生じる遺伝子変異量(Tumor mutational burden、TMB)が、メラノーマや非小細胞性肺がんに対するチェックポイント阻害剤治療のバイオマーカーとして報告されている。ミスマッチ修復(MMR)機能欠損、BRACA2やP53変異が、腫瘍の遺伝子変異を増やす原因となる(3)。一塩基変異(SNV)が少ない腎がんでは、フレームシフトによって多数のネオアンチゲンが生じることが知られている。TMBが多いがん細胞ほど、ネオアンチゲンが多く、免疫系に認識されやすいと期待されるが、腫瘍の免疫原性と遺伝子変異量は、単純にリニアな関係では説明困難である。腫瘍の免疫原性は、遺伝子変異がすべてのがん細胞に存在するか(Clonal)、一部のがん細胞にのみ存在するか(Subclonal)で生じるネオアンチゲンの質も考慮される必要がある。
さらに、がん細胞が免疫細胞に認識されるには、がん抗原が適切に細胞表面上に抗原提示される必要がある。抗原提示にかかわる分子の異常、とりわけβ2ミクログロブリン(β2M)の機能喪失型変異は、がん細胞上のすべてのHLA分子の発現に影響するため、治療抵抗性の獲得症例での新たな異常の出現が報告されている。IFNγは、がん細胞の増殖や生存に直接関与するのみならず、抗原提示分子の発現増強にも関与していることから、IFNγ受容体とそのシグナル伝達分子の発現も、免疫チェックポイント阻害剤の効果に深く関与している。このように、抗腫瘍免疫応答に対する腫瘍自身の感受性を規定する腫瘍内在性因子がバイオマーカーとして報告されている。
2)腫瘍微小環境
腫瘍と免疫応答の相互作用で形成される微小環境も重要なバイオマーカーである。抗腫瘍免疫応答の評価には、T細胞のみならず、腫瘍関連マクロファージ、NK細胞、B細胞なども含めて免疫細胞の組成とその局在と治療効果の関係が重要である。CD8+T細胞や細胞傷害性T細胞、パーフォリンやグランザイムなどの細胞傷害性因子の発現がバイオマーカーとして報告されているが、腫瘍内に浸潤するT細胞は、PD-L1の発現の誘導、制御性T細胞や骨髄由来抑制細胞などの免疫抑制性の細胞浸潤を伴う。腫瘍内の低酸素状態、pH、活性酸素、グルコースや脂質代謝における腫瘍と免疫細胞の競合などがさらに抗腫瘍免疫応答に影響を及ぼすことが知られている。
3)宿主、個体レベルの因子
全身の免疫状態に影響を及ぼす因子、環境因子も、チェックポイント阻害剤のバイオマーカーになり得る。喫煙などの生活習慣、カロリー摂取と肥満、感染、常用する薬剤、日光や大気、放射線などの環境因子は免疫に影響することが知られている。チェックポイント阻害剤と腸内微生物叢の関係では、グラム陽性低GC含量細菌のフィルミクテスが有効例、ブラム陰性細菌のバクテロイデスが無効例と相関することが報告されている。宿主の遺伝学的素因も関連する。IgG1抗体であるイピリムマブと結合するFcγ受容体の遺伝子多型、CD16V158F遺伝子多型と治療効果の相関が報告されている。ヒトMHCクラスI分子には、HLA-A、-B、-Cの三つの遺伝子があり、父母由来で最大で6つの遺伝子を持っている。父由来と母由来のHLA遺伝子が異なる(ヘテロ接合性)患者は、父母由来のHLA遺伝子が同じホモ接合性の患者より多様なペプチドを抗原提示することが可能であることから、免疫チェックポイント阻害剤治療において、より良好な全生存期間が認められたと報告されている。このように、宿主/個体レベルの因子も免疫チェックポイント阻害剤のバイオマーカー候補に含まれている。
8.2.バイオマーカーの統合的解析
次世代シーケンサー(NGS)の登場でがんゲノム研究が飛躍的に発展し、がん免疫研究においても、バイオインフォマティクス解析ツールを駆使したがん免疫ゲノム解析が不可欠となってきた。TCGA(The Cancer Genome Atlas)では、20種類以上のがん種について、ゲノム情報に加えて、メチル化異常、遺伝子・タンパク質発現などについて網羅的な解析結果が公開されており、それを活用して、複雑ながん-免疫相互作用を解明する試みが飛躍的に進歩している。NGS解析で蓄積された手法が、バイオマーカーの統合的解析に応用されている。TCGAのデータや免疫チェックポイント阻害剤の治験において得られた情報をもとに、様々な統合的バイオマーカーが提唱されている。膨大なデータを処理するために、機械学習や深層学習などAIの活用が免疫ゲノム研究にも導入されてきた。
8.3.がん免疫サイクルを反映するイムノグラム
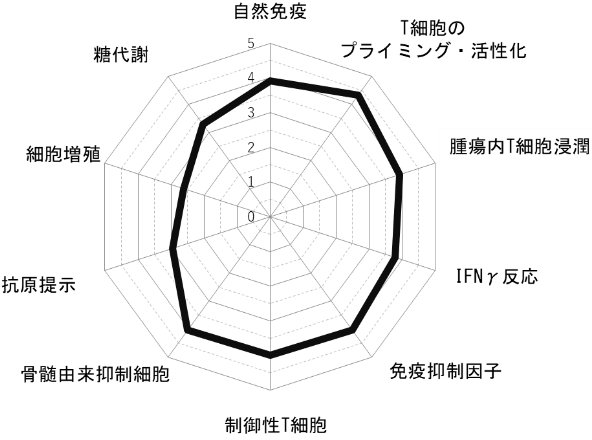
我々は、これまでに蓄積された腫瘍免疫学に基づくKnowledge-basedのバイオマーカーとして、網羅的遺伝子解析データの中から、がん免疫サイクルの各ステップに関連する因子について、それに関わる遺伝子群の発現データを抽出してスコア化し、レーダーチャートを用いて可視化するがんイムノグラム(Cancer Immunogram)解析を構築した。イムノグラムの軸として,がん免疫サイクルの各ステップの評価に加えて、がん免疫相互作用を反映するために、腫瘍の増殖・代謝にかかわる因子を加えた。また、各軸が治療介入の指標となるように、1)自然免疫、2)T細胞のプライミング・活性化、3)腫瘍内T細胞浸潤、4)IFNγ反応、5)免疫抑制因子、6)制御性T細胞、7)MDSC、8)抗原提示、9)細胞増殖、10)糖代謝からなる10の軸を設定した。これにより、がんイムノグラムは,末梢血から腫瘍細胞・腫瘍周囲環境までの腫瘍免疫の全体像を評価することが可能であり,今後がん種や治療法などに応じて,評価する軸を増やしていくことで,免疫チェックポイント阻害薬を含む免疫療法の効果を個別に予測するあらたなバイオマーカーとなりうる可能性を秘めている。