Specialty研究内容
研究内容の詳細
1.抗腫瘍免疫応答の解析
免疫細胞治療学講座には、毎週複数の腫瘍組織や血液検体が届く。東大病院の外科の先生が、手術室から、あるいは病理標本室から連絡をくれると、直ちにスタッフが出動して検体を受け取り、研究室で処理を開始する。学外の施設からも、温度・安全管理の下、検体が届くことから、多数の臨床検体を解析することが可能である。腫瘍浸潤リンパ球を培養したり解析したりするためには、まず腫瘍を酵素分解して単細胞サスペンジョンを作製し、直ちに培養あるいは、解析日まで凍結保存している。治療前後の変化を観察するため、経時的なフォローアップも重要でるため、各診療科の先生と緊密に連携し、貴重な臨床検体を用いた研究を実施している。
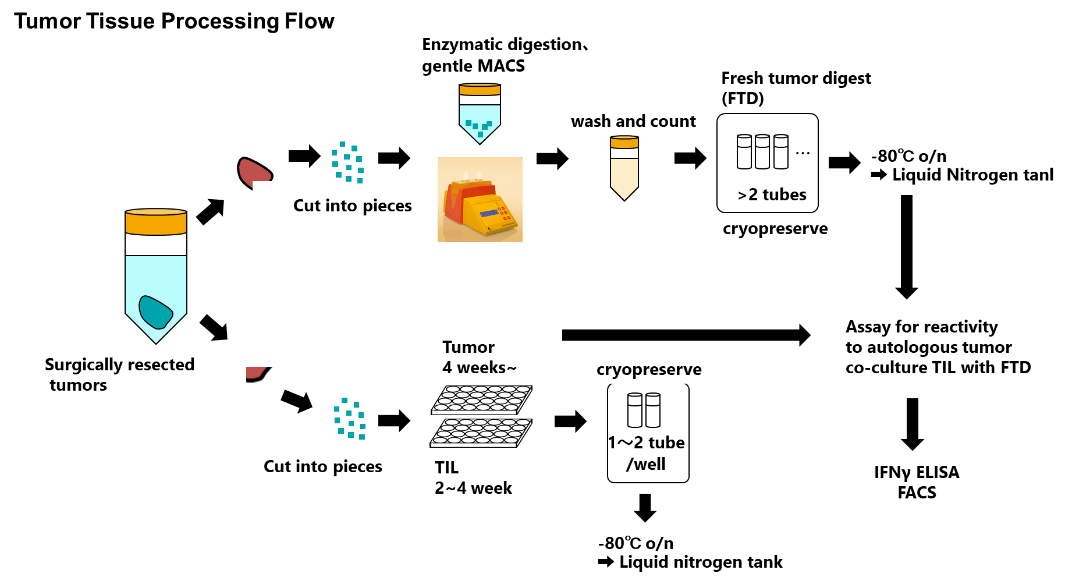
検体が朝一番に届くことはありません。午前中や午後早い時間なら助かりますが、夕方検体が届くと、そこから処理が始まります。できるだけ迅速に処理することで、より質の高いアッセイが可能であることから、スタッフが毎日頑張ってくれています。
1.1フローサイトメーターを用いた抗腫瘍免疫応答の解析
分子標的薬治療を受ける腎がん患者の免疫機能評価
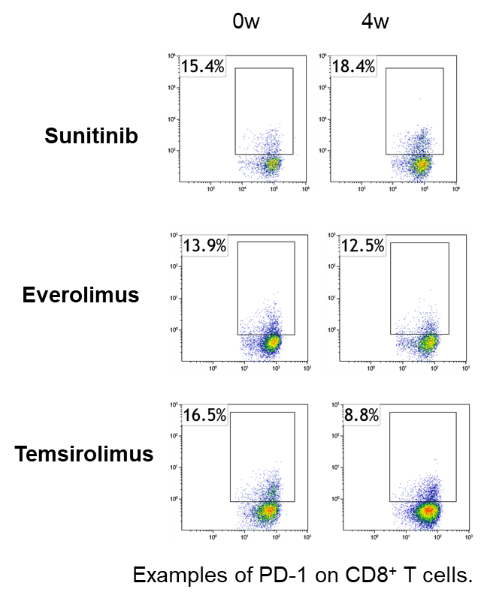
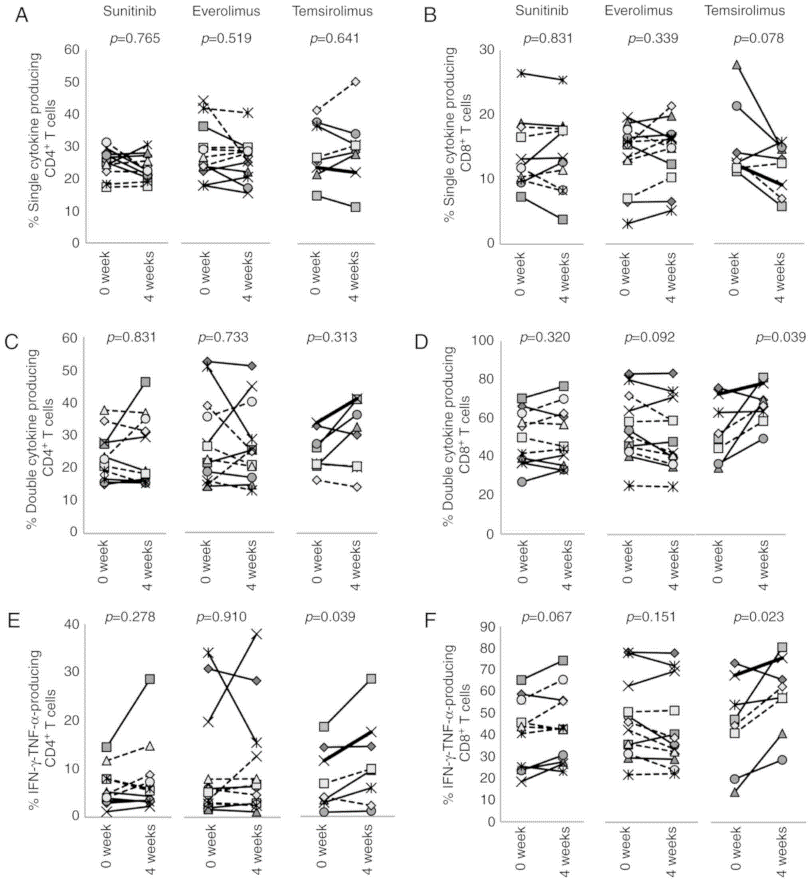
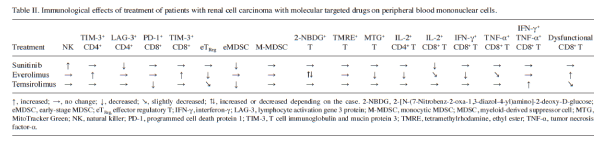
抗腫瘍免疫応答の評価の基本は、免疫細胞の種類、形質、機能の評価です。スニチニブ(TKI阻害剤)、エベロリムス(mTOR阻害剤)、テムシロリムス(mTOR阻害剤)の投与を受けた腎がん患者の治療前後の末梢血を解析し、分子標的薬治療による免疫制御効果を明らかにしました。特に、エベロリムスとテムシロリムスは、同じmTOR阻害剤でありながら、エベロリムスの投与を受けた患者では免疫抑制側、テムシロリムスの投与を受けた患者では、PD-1の発現が低下し、IFNγやTNFα産生能を持ったリンパ球の増加を認め、免疫活性側の作用を持つことを明らかにしました。
- 発表論文
-
- Kobayashi Y, Yamada D, Kawai T, Sato Y, Teshima T, Yamada Y, Nakamura M, Suzuki M, Matsumoto A, Nakagawa T, Hosoi A, Nagaoka K, Karasaki T, Matsushita H, Kume H, Kakimi K. Different immunological effects of the molecular targeted agents sunitinib, everolimus and temsirolimus in patients with renal cell carcinoma. Int J Oncol. 2020 Apr;56(4):999-1013.
膵がん患者における抗腫瘍免疫応答の評価
膵切除術を受ける膵がん患者の免疫応答が、術後再発までの予後と相関することを明らかにしました。末梢血中のNK細胞が多い患者、腫瘍のRNA-Seq解析において、Type I、Type II IFN関連遺伝子発現(シグネチャー)を認める患者では、再発までの期間が長い一方、腫瘍内のトランスクリプトーム解析でKRAS経路の活性化やEMTを認める患者では、再発までの期間が短いことが明らかになった。
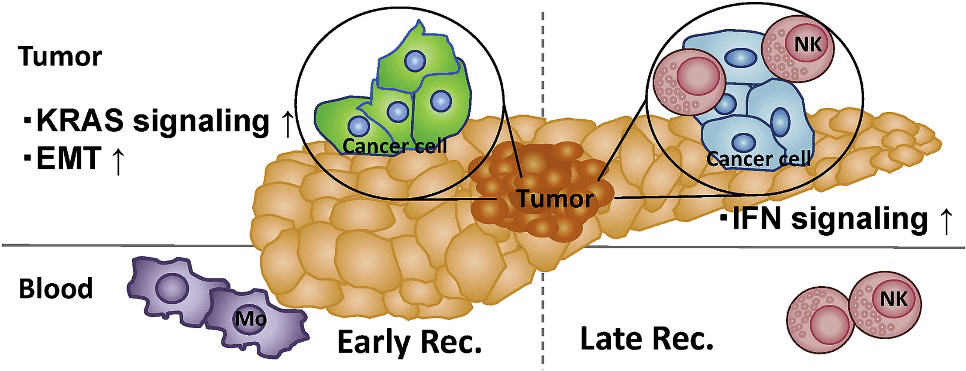
- 発表論文
-
- Hoshikawa M, Aoki T, Matsushita H, Karasaki T, Hosoi A, Odaira K, Fujieda N, Kobayashi Y, Kambara K, Ohara O, Arita J, Hasegawa K, Kakimi K, Kokudo N. NK cell and IFN signatures are positive prognostic biomarkers for resectable pancreatic cancer. Biochem Biophys Res Commun. 2018 Jan 8;495(2):2058-2065.
テトラマーを用いたネオアンチゲン反応性T細胞の解析
我々の質の高い解析技術が評価され、新し免疫解析技術の評価を依頼されることが増えてきました。例えば、MBLさんからは、QuickSwitch カスタム テトラマーキットの評価を依頼された。
富士フイルム和光純薬さんからは、Empty Tetramerの評価を依頼された。
いずれもテトラマーを用いて抗原特異的CD8+T細胞の検出を行うことができました。
腫瘍浸潤リンパ球(Tumor-infiltrating lymphocyte: TIL)の培養
腫瘍特異的リンパ球を含んだTILを増殖させ、患者に投与するTIL治療は非常に強力な治療であるが、メラノーマ以外のがんでは、TILの培養増殖は容易ではない。腫瘍内の免疫抑制性の環境により、疲弊状態に陥ったTILは、短期間の培養にたけることは可能であるが、次第に増殖能を欠如し、死滅することが多い。そこで、TILを培養中に、その抗原特異性を評価し、ネオアンチゲンに反応する腫瘍特異的T細胞を同定することが可能であれば、そのTCR遺伝子をクローニングして、新たに増殖能を持った患者のT細胞に導入して腫瘍特異的T細胞を複製可能である。このようなTCR-T細胞の実現に向けて、切除標本からのTILの培養を実施している。

1.2NGSを用いた抗腫瘍免疫応答の解析
イムノグラム
がんと免疫のダイナミックな相互作用は、免疫細胞の「腫瘍-リンパ組織-末梢組織・血液」などの解剖学的な部位の移動と経時的な変化の影響下にあるため、ダイナミックなシステムとして捉えて評価することが必要である。ChenとMellmanは、腫瘍特異的T細胞の誘導過程に関する知識を総括し、がん免疫応答を一連のサイクルとして評価する「がん免疫サイクル(Cancer Immunity Cycle)」という概念を提唱した(Immunity 39, 1-10 (2013))。腫瘍特異的T細胞による抗腫瘍免疫応答を①腫瘍抗原の放出、②抗原提示細胞(antigen presenting cell, APC)による腫瘍抗原の取り込みとリンパ節への遊走、③T細胞への抗原提示と抗原特異的T細胞の活性化、④活性化T細胞の遊走、⑤腫瘍組織への浸潤、⑥腫瘍細胞の認識、⑦攻撃、からなる次の7つのステップで構成される。T細胞に攻撃され細胞死を起こした腫瘍細胞は新たな腫瘍抗原を放出し,①に戻る。この一連のサイクルにおいて、いずれのステップが障害されても効果的ながん免疫応答の誘導が困難となり、がんは免疫監視機構から逃避する。
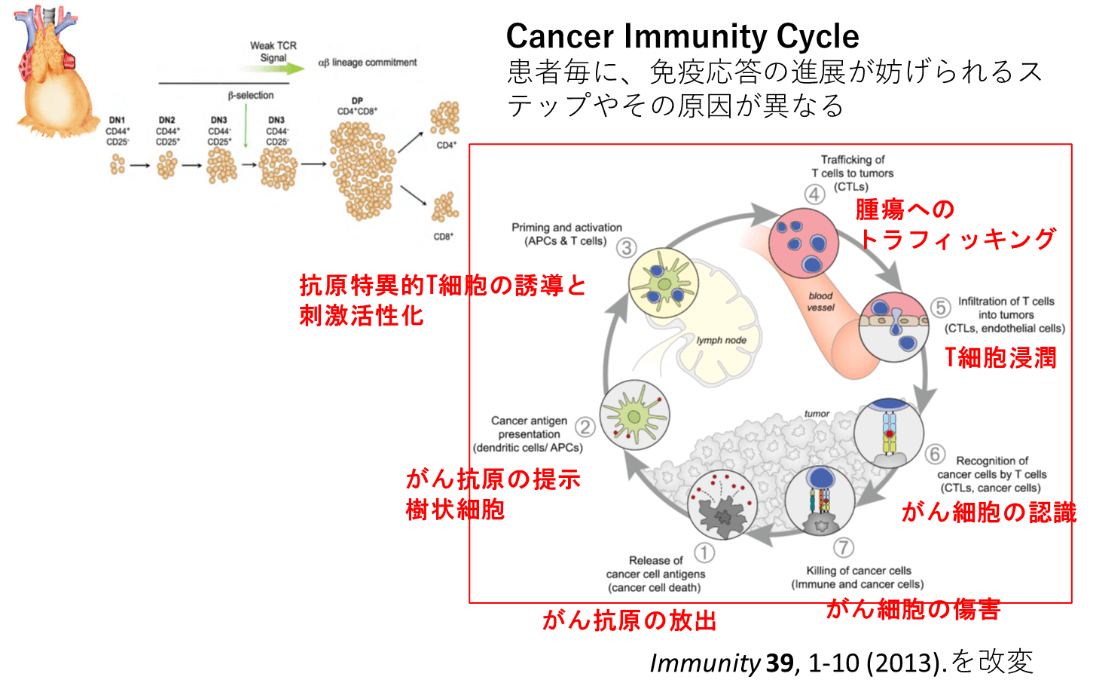
胸腺においてTCRの遺伝子再配列を受けたT細胞は、リンパ節で抗原刺激を受けCancer Immunity Cycleで示された各ステップを経て腫瘍に到達し、抗腫瘍効果を発揮する。がん免疫サイクルの各ステップの進行には、ある閾値が存在し、それを超えると次のステップへと進行し、最終的に抗腫瘍免疫応答が誘導されると期待される。遺伝的素因、年齢、腸内細菌叢、ウイルス感染、日光照射などの環境因子、代謝、食事、運動、併用する治療薬による免疫修飾など多様な因子が、免疫に関連するサイトカインや細胞の制御に関わっており、これらの免疫応答を誘導する因子と抑制する因子のバランスによって個々の患者毎の閾値が規定される。がん免疫応答を誘導しやすい患者とそうでない患者において、個々の患者毎にこの閾値が異なることが予想され、それをがん免疫セットポイントとして評価することが提案されている(Nature. 2017;541(7637):321-30)。腫瘍免疫反応は多くの因子の微妙なバランスによって成立しており、鍵となる因子を同定できれば、その因子を制御することで、閾値を変化させ、non-inflamedタイプの腫瘍をinflamedタイプに変化させることが可能になると期待される。したがって、バイオマーカーの統合的解析、あるいは多因子からなるバイオマーカーの網羅的なチェックリストが求められる。
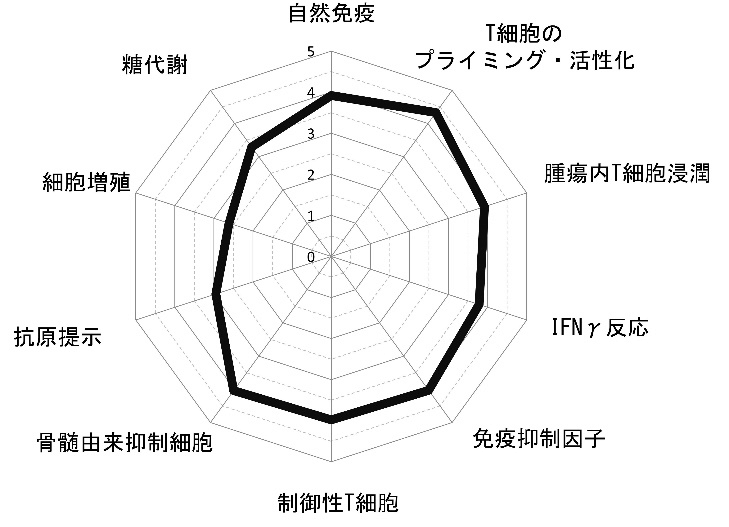
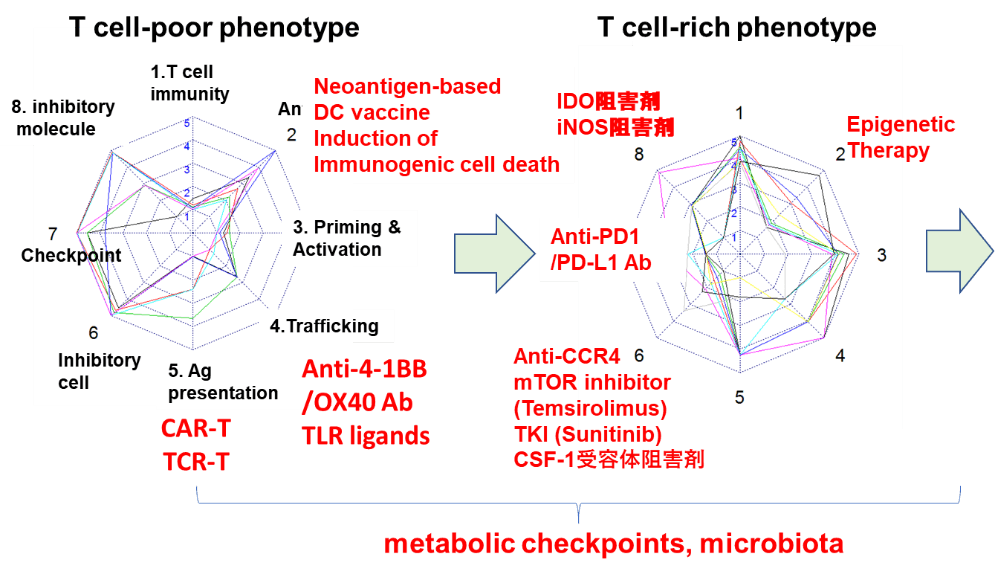
我々は、これまでに蓄積された腫瘍免疫学に基づくKnowledge-basedのバイオマーカーとして、網羅的遺伝子解析データの中から、がん免疫サイクルの各ステップに関連する因子について、それに関わる遺伝子群の発現データを抽出してスコア化し、レーダーチャートを用いて可視化するがんイムノグラム(Cancer Immunogram)解析を構築した。イムノグラムの軸として,がん免疫サイクルの各ステップの評価に加えて、がん免疫相互作用を反映するために、腫瘍の増殖・代謝にかかわる因子を加えた。また、各軸が治療介入の指標となるように、1)自然免疫、2)T細胞のプライミング・活性化、3)腫瘍内T細胞浸潤、4)IFNγ反応、5)免疫抑制因子、6)制御性T細胞、7)MDSC、8)抗原提示、9)細胞増殖、10)糖代謝からなる10の軸を設定した(図)。これにより、がんイムノグラムは,末梢血から腫瘍細胞・腫瘍周囲環境までの腫瘍免疫の全体像を評価することが可能であり,今後がん種や治療法などに応じて,評価する軸を増やしていくことで,免疫チェックポイント阻害薬を含む免疫療法の効果を個別に予測するあらたなバイオマーカーとなりうる可能性を秘めている。
20例の肺がん患者の腫瘍を解析したイムノグラムを示す。いずれも形が異なり、腫瘍内の免疫応答は、一人一人の患者で異なることが明確に図示される。
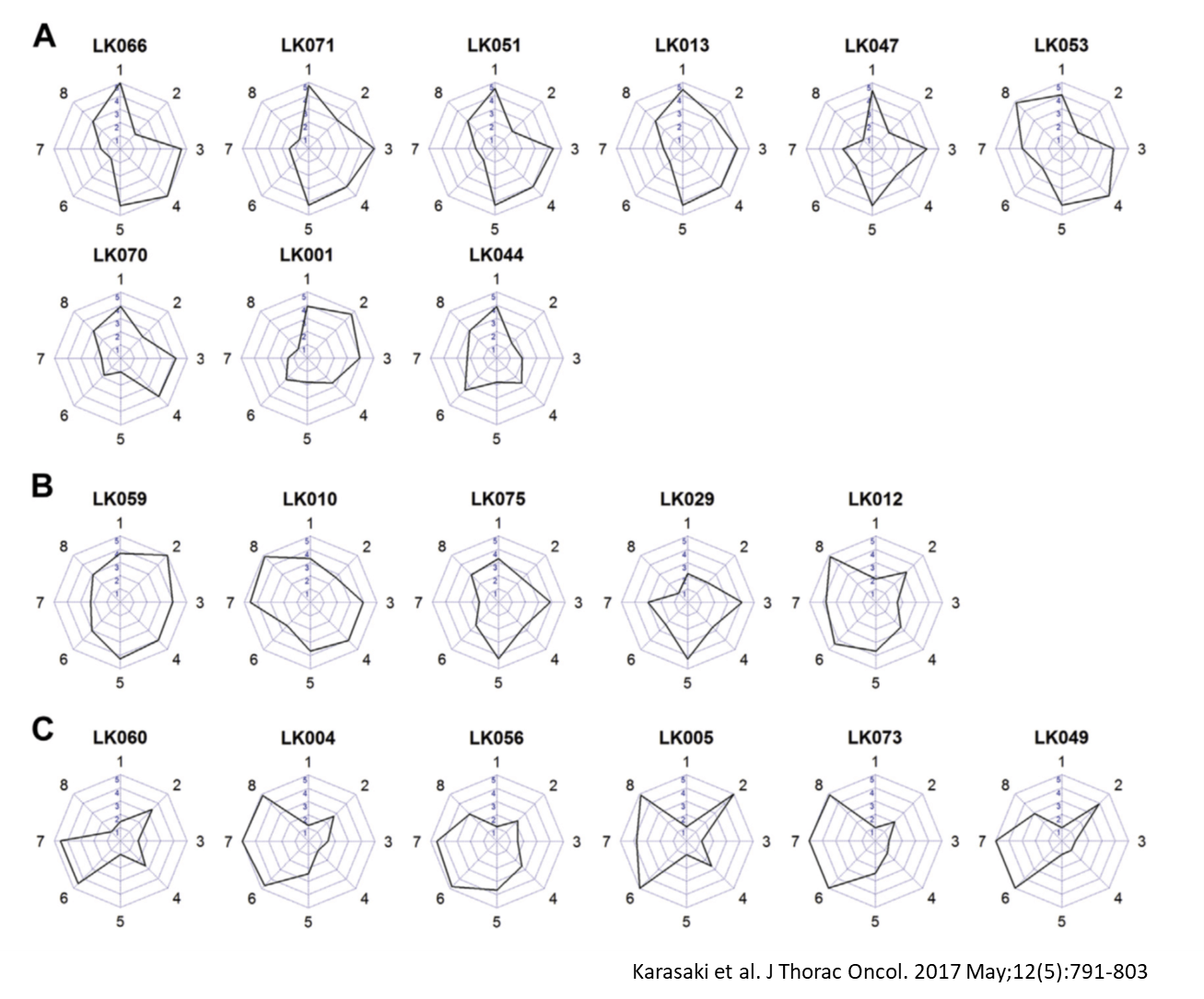
一人ひとりの患者において、免疫サイクルのどこに問題があるのか?その問題を見つけることが医者に求められている。抑制されているポイントは一つとは限らない。複数の免疫制御が必要であることから、複合的がん免疫治療が必要である。そして、その組み合わせ(複合的がん免疫治療)も、一人ひとり異なることから、個別化がん免疫治療としての対応が必要である。これからのがん免疫治療は、「個別化」と「複合化」をキーワードとして、より効果的ながん免疫治療を患者に提供することが求められる。そのために、イムノグラム解析は非常に有効なツールとなると期待される。
- 発表論文
-
- Karasaki T, Nagayama K, Kuwano H, Nitadori JI, Sato M, Anraku M, Hosoi A, Matsushita H, Morishita Y, Kashiwabara K, Takazawa M, Ohara O, Kakimi K, Nakajima J. An Immunogram for the Cancer-Immunity Cycle: Towards Personalized Immunotherapy of Lung Cancer. J Thorac Oncol. 2017 May;12(5):791-803.
- Kobayashi Y, Kushihara Y, Saito N, Yamaguchi S, Kakimi K. A novel scoring method based on RNA-Seq immunograms describing individual cancer-immunity interactions. Cancer Sci. 2020 Aug 18. doi: 10.1111/cas.14621.PMID: 32810311.
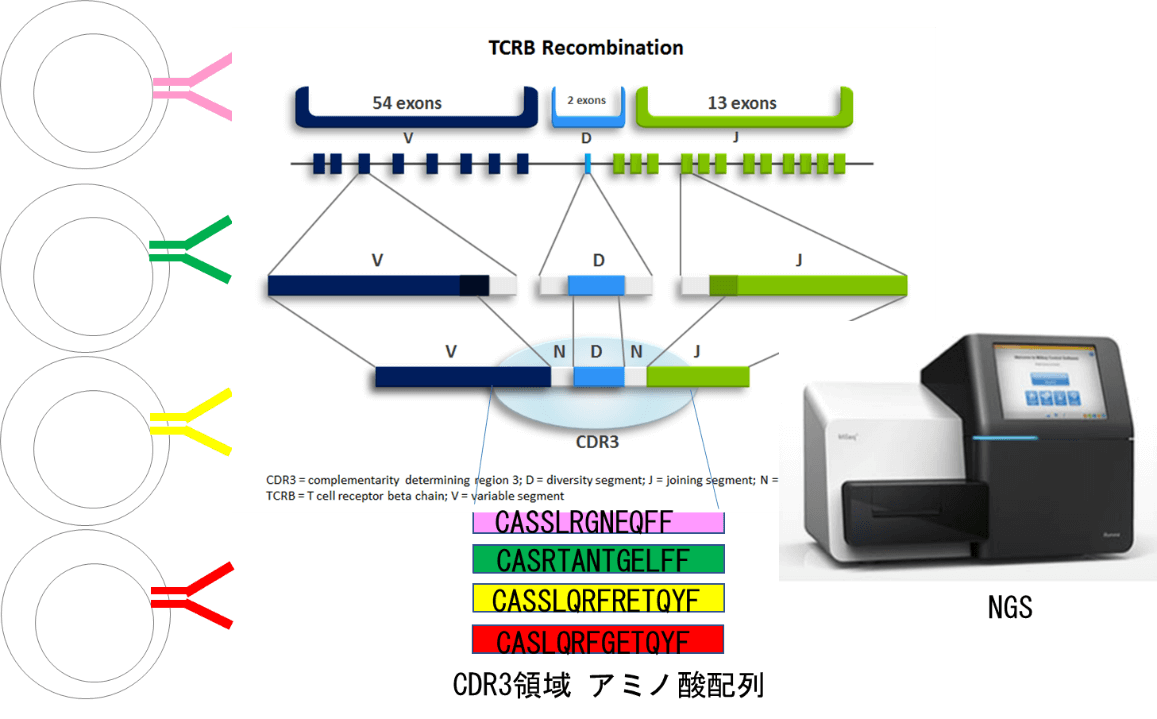
T細胞受容体(TCR)レパトア解析
TCRはT細胞上に発現する受容体で、この受容体で抗原提示細胞や感染細胞、がん細胞などの表面にあるMHC分子上にのった抗原ペプチドを認識する。様々な抗原に対応するために、T細胞受容体はB細胞受容体と同様に遺伝子再編成を受けて多様な種類のものが作られる。αβT細胞のα鎖はTCR遺伝子のV領域とJ領域、β鎖はV領域、D領域、J領域の組み合わせから構成される。その中でも最もバリエーションが多いとされているCDR3領域で抗原を認識しているが、理論上、この組み合わせで1018通りのTCRができることになる、というものすごい多様性を持っている。このCDR3領域を増幅させたのち、NGSで配列を決定することで、CDR3領域のアミノ酸配列を決定し、T細胞のタグとして使用することで、T細胞の集団のレパトアを解析可能になった。
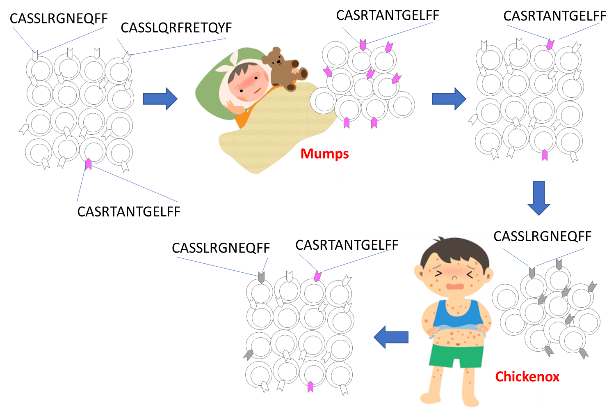
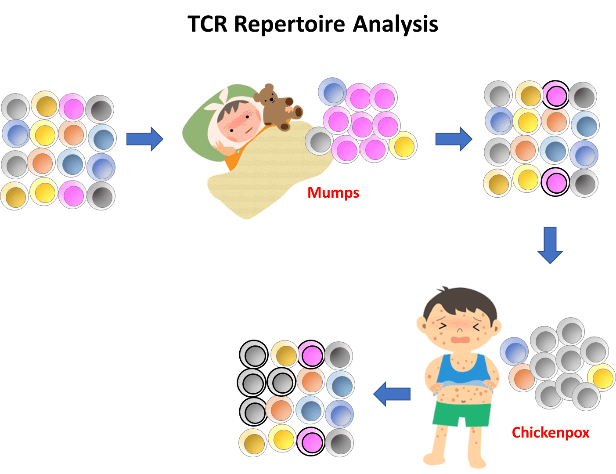
おたふくかぜや水ぼうそうなど、子供の時にかかると、免疫が成立し再感染から守られる。この時、ウイルス特異的なT細胞がメモリー細胞として体内に持続している。例えば、図で示すように、おたふくかぜにかかった後、ピンク色のおたふくかぜ特異的なT細胞が増殖してウイルスを制御しそののち、メモリー細胞として残存する。次に水ぼうそうにかかると、今度はグレーの水ぼうそう特異的T細胞が増殖し、感染が終了すると、メモリー細胞として体内に持続してウイルス感染からの防御を担っている。実際のリンパ球には、このような色はついていないため、リンパ球の集団内の構成を把握することは困難であった。しかしながら、各リンパ球には、それぞれ固有のTCRを持つことから、このCDR3領域の配列をタグとして用いることでクローン増殖したT細胞や、特定のT細胞の長期間のフォローアップが可能である。
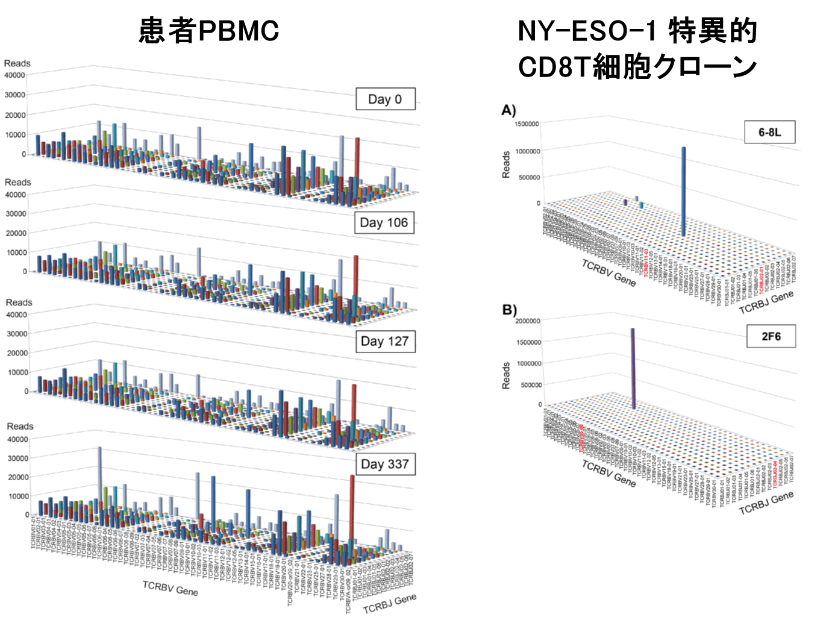
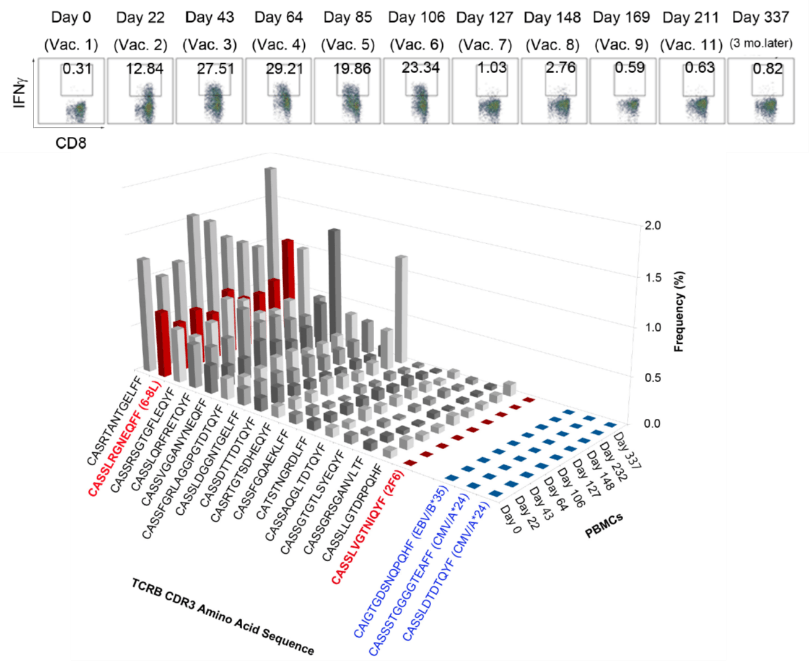
NY-ESO-1ペプチドがんワクチンの投与を受けた患者の末梢血PBMC中には、がんに限らず様々な抗原に対するT細胞が存在する。そこで、NY-ESO-1特異的CD8+T細胞のCDR3配列を同定し、それを用いてPBMC中に存在するNY-ESO-1特異的CD8+T細胞の頻度を解析した。細胞内IFNγ染色法を用いた解析によると、ワクチンの投与を受ける前には、血中には、NY-ESO-1特異的CD8+T細胞は存在しなかったが、ワクチンを1回投与した後(Day21)、末梢血中のCD8+T細胞中12.84%がNY-ESO-1ペプチドに反応してIFNγを産生した。ワクチン投与中、IFNγ産生細胞は増加し、投与6回目には23.34%のCD8+T細胞がIFNγ陽性であった。ところが、ワクチンの投与を12回まで続けたところ、7回目から患者の末梢血中にIFNγ産生細胞が検出できなくなってしまった。
NGSを用いたTCRのCDR3領域の配列に基づいた解析では、NY-ESO-1特異的T細胞は、ワクチン投与前からPBMC中に存在し、投与中も、また投与後もその頻度に大きな変化は見られなかった。この結果から、がんワクチンは、NY-ESO-1特異的T細胞を増やしたのではなく、既に存在したNY-ESO-1特異的T細胞を活性化し、IFNγ産生を可能にした。しかしながら、ワクチン投与を継続すると、NY-ESO-1特異的T細胞をexhaustさせ、IFNγ産生能を喪失させたと考えられた。このように、従来の免疫モニタリングと、NGSを用いた免疫モニタリングが相互に補完して新しい事実が明らかになる。
担癌マウスの脾臓内のTリンパ球と腫瘍浸潤T細胞のレパトア解析比較を見ると(表)、脾臓内では、最も多いCDR3配列でも0.29%で、約10,000種類のCDR3配列が検出された。一方、腫瘍内では、CDR3配列の種類は1,000種類と減少し、ある特定の配列を持つリンパ球が39.48%、12.93%、3.95%とクローナルに増殖していた。
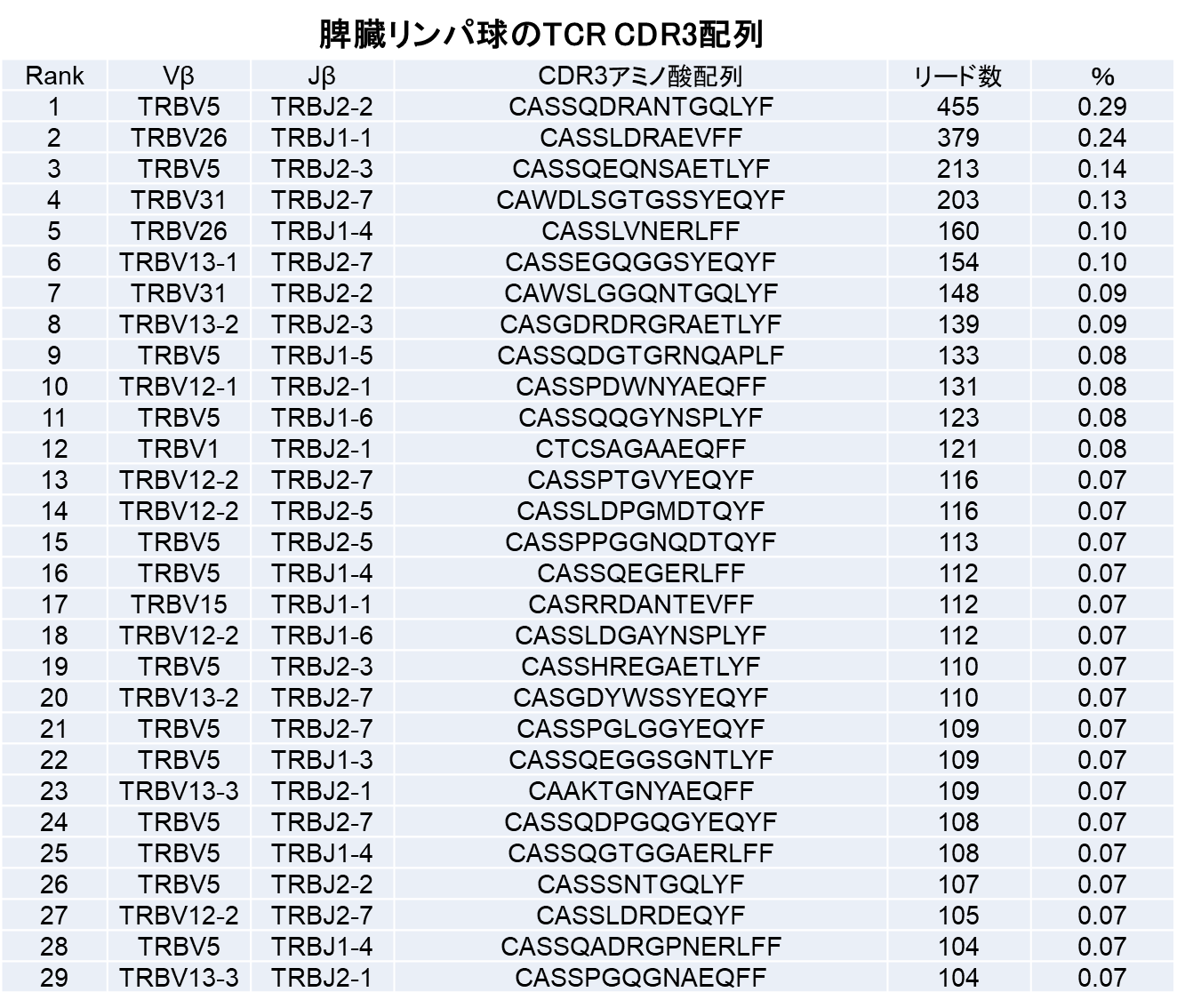
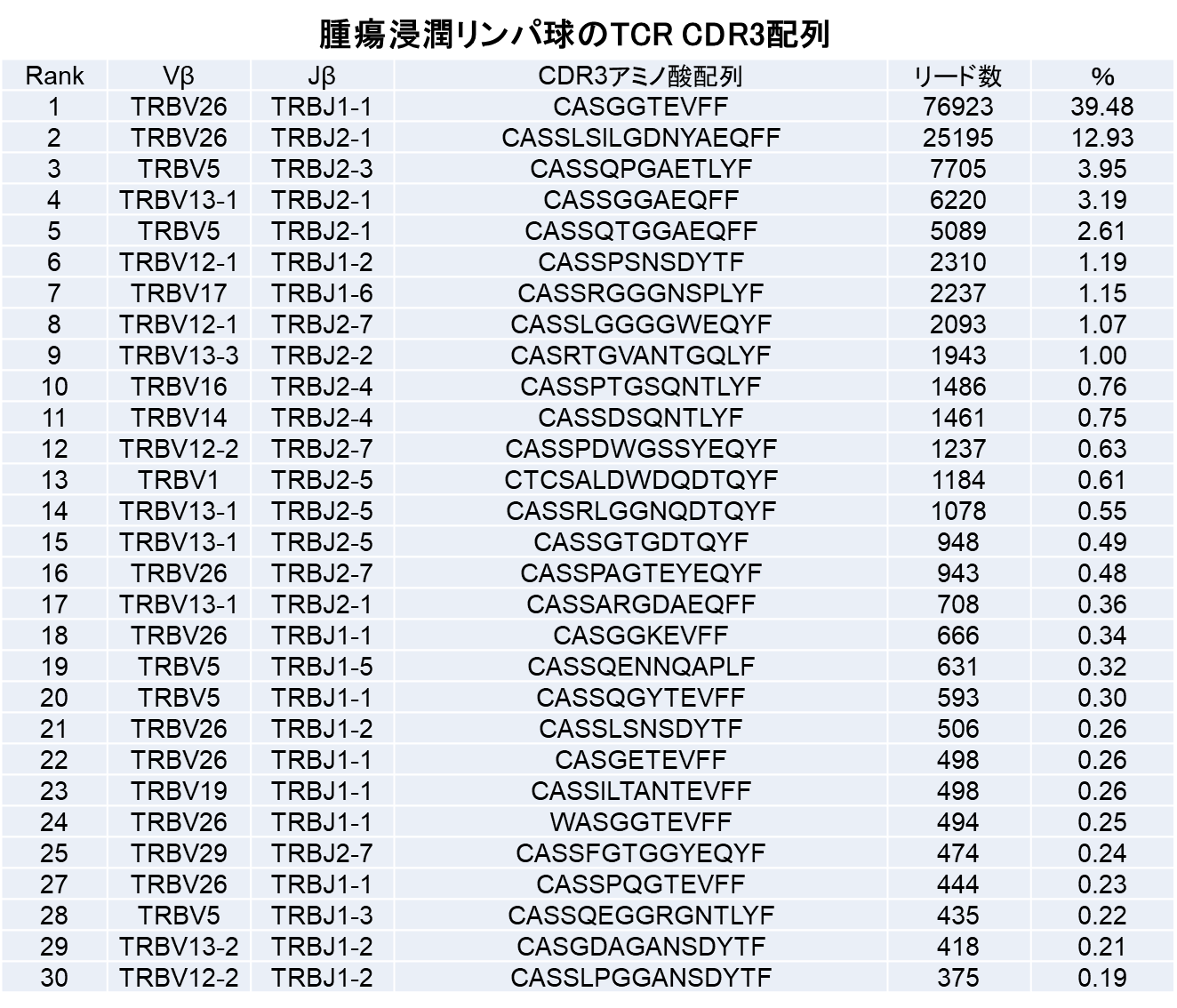
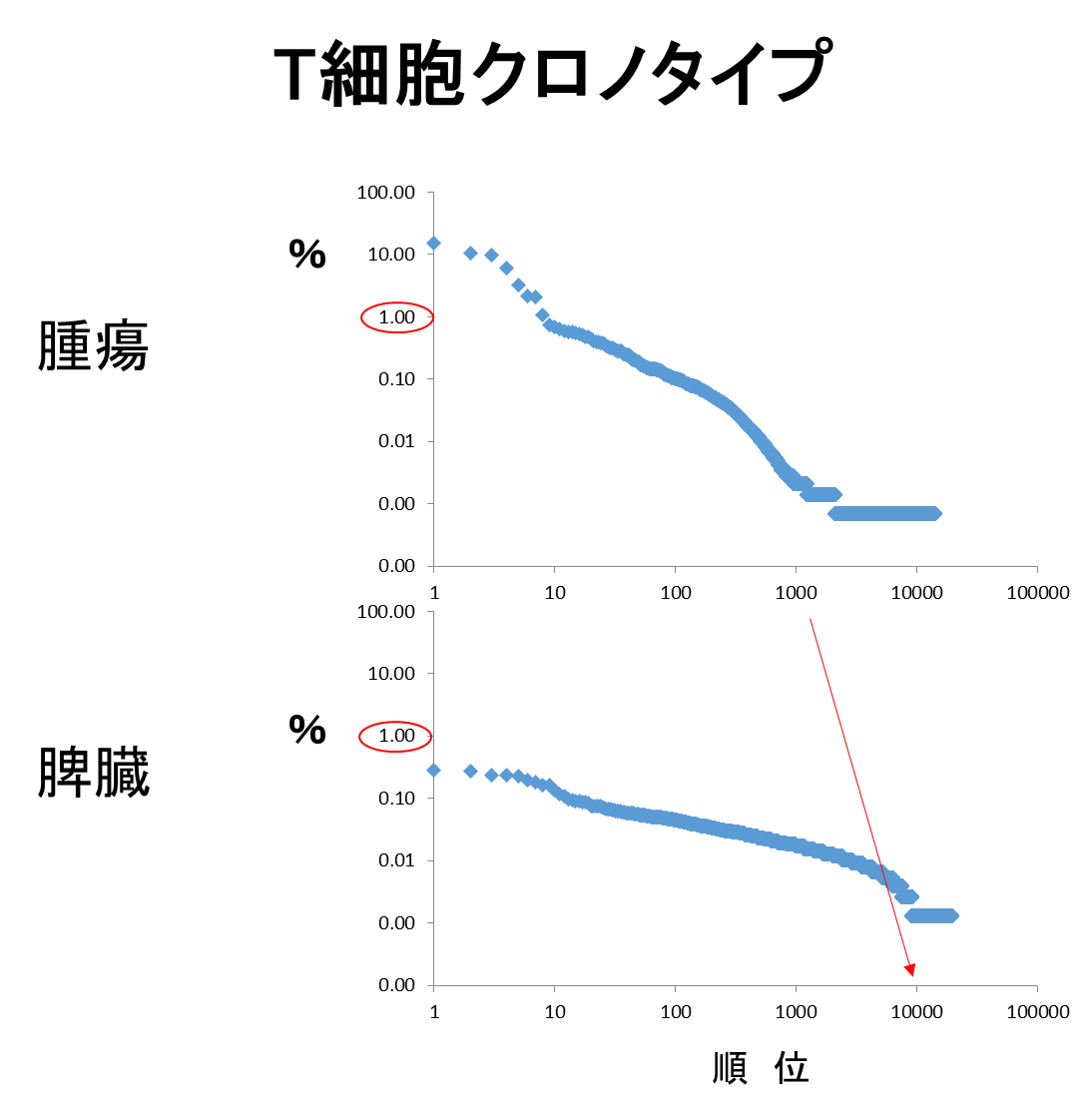
TCRレパトア解析において、T細胞集団のClonalityとDiversityが評価される。Diversityには、種類の豊富さを表すRichnessと、偏り、均等性をあらわすEvennessの両社が存在する。腫瘍内の免疫応答においては、T細胞の種類が多いDiversityではなく、腫瘍特異的なT細胞の増殖を示す偏り(Evenness)による多様性(Diversity)が重要であることを明らかにした。
- 発表論文
-
- Miyai M, Eikawa S, Hosoi A, Iino T, Matsushita H, Isobe M, Uenaka A, Udono H, Nakajima J, Nakayama E, Kakimi K. Detection and Tracking of NY-ESO-1-Specific CD8+ T Cells by High-Throughput T Cell Receptor (TCRB) Gene Rearrangements Sequencing in a Peptide-Vaccinated Patient. PLoS One. 2015 Aug 20;10(8):e0136086.
- Hosoi A, Takeda K, Nagaoka K, Iino T, Matsushita H, Ueha S, Aoki S, Matsushima K, Kubo M, Morikawa T, Kitaura K, Suzuki R, Kakimi K. Increased diversity with reduced "diversity evenness" of tumor infiltrating T-cells for the successful cancer immunotherapy. Sci Rep. 2018 Jan 18;8(1):1058.
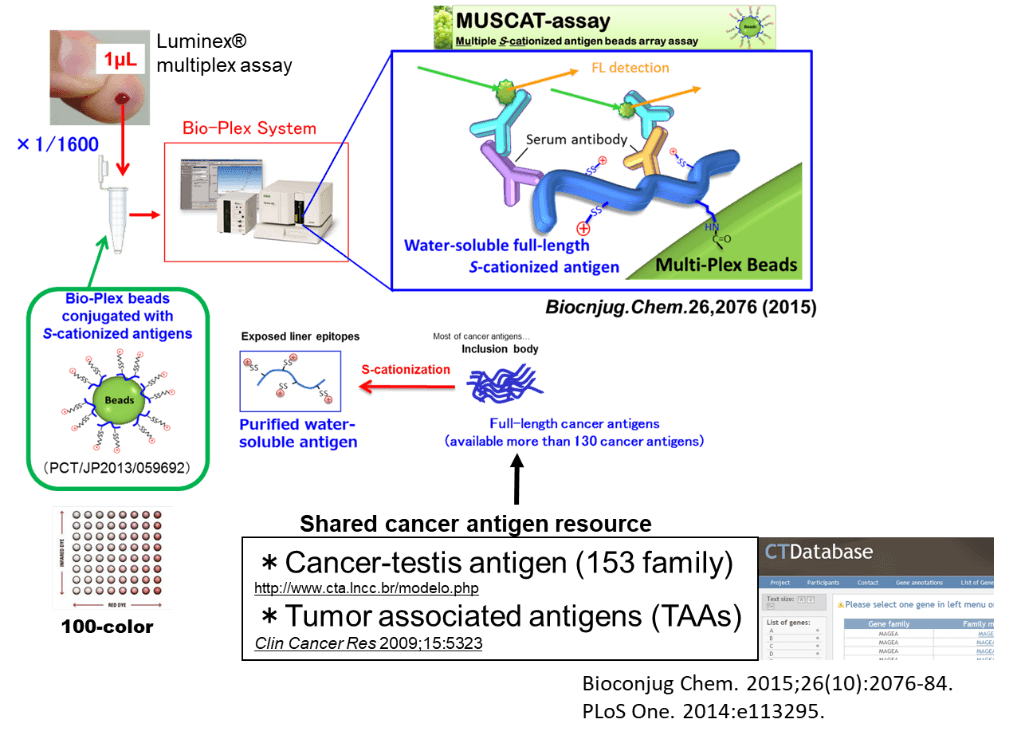
1.3マルチプレックス抗体アッセイ
岡山大学工学部二見淳一郎准教授と共同研究で、がん抗原に対する抗体反応を効率よく検出するシステムを構築しました。二見先生が岡山ということで、Multiplex S-cationized antigen beads array assayを略してMUSCAT assayと名付けました。免疫治療前後の患者の血清中の抗体反応を用いて、免疫チェックポイント阻害剤治療に反応性が期待できる患者を予測可能であることを見いだしました。また、免疫治療に限らず、手術や分子標的薬、放射線治療でも、患者の体内での免疫応答の評価の指標としてMUSCAT assayの活用が期待されています。

- 発表論文
-
- Futami J, Fujiyama H, Kinoshita R, Nonomura H, Honjo T, Tada H, Matsushita H, Abe Y, Kakimi K. Denatured mammalian protein mixtures exhibit unusually high solubility in nucleic acid-free pure water. PLoS One. 2014 Nov 18;9(11):e113295.
- Futami J, Nonomura H, Kido M, Niidoi N, Fujieda N, Hosoi A, Fujita K, Mandai K, Atago Y, Kinoshita R, Honjo T, Matsushita H, Uenaka A, Nakayama E, Kakimi K. Sensitive Multiplexed Quantitative Analysis of Autoantibodies to Cancer Antigens with Chemically S-Cationized Full-Length and Water-Soluble Denatured Proteins. Bioconjug Chem. 2015 Oct 21;26(10):2076-84.
- Ohue Y, Kurose K, Karasaki T, Isobe M, Yamaoka T, Futami J, Irei I, Masuda T, Fukuda M, Kinoshita A, Matsushita H, Shimizu K, Nakata M, Hattori N, Yamaguchi H, Fukuda M, Nozawa R, Kakimi K, Oka M. Serum Antibody Against NY-ESO-1 and XAGE1 Antigens Potentially Predicts Clinical Responses to Anti-Programmed Cell Death-1 Therapy in NSCLC. J Thorac Oncol. 2019 Dec;14(12):2071-2083.

