Tumor
Immunity腫瘍免疫の基礎知識(垣見の腫瘍免疫学)
免疫細胞治療学講座で実施している研究のベースとなる腫瘍免疫に関する基礎知識、考え方を概説します。
3.ネオアンチゲン
最近、遺伝子変異によって生じたネオアンチゲンが注目されている。がん免疫の分野の世界的権威であるSteven A. Rosenberg博士は、ネオアンチゲンに関して、‛Final common pathway' of human cancer immunotherapy: targeting random somatic mutations…T cells that target tumor neoantigens arising from cancer mutations are the main mediators of many effective cancer immunotherapies in humans (Tran E, Nat Immunol. 2017; 18(3):255-62)と、その重要性を強調されています。 18(3):255-62)と、その重要性を強調されています。
がん細胞はがん化の過程で多くの体細胞遺伝子突然変異を細胞内に蓄積する。これらの遺伝子産物も他のタンパクと同様に、細胞質内でプロテアソームによる分解を受けてペプチドに分解されたのち小胞体内へ輸送され、MHCクラスI分子への結合とアミノ酸のトリミングを受ける。そしてMHCペプチド複合体として細胞表面に提示される。アミノ酸変異を伴う遺伝子変異産物のうち、一部のものはMHCクラスI分子に結合し提示され、T細胞受容体によって認識される抗原となる。胸腺内で発現を認めないネオアンチゲンは、胸腺での中枢性の免疫寛容を回避できることから、高い免疫原性を有する可能性があると考えられている。抗腫瘍免疫応答が誘導される際、このネオアンチゲンがT細胞の標的となり、腫瘍拒絶にかかわる抗原になりうることが示されている。
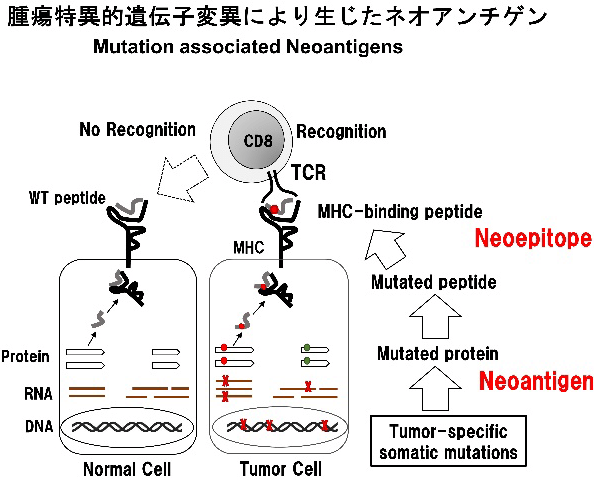
免疫チェックポイント阻害剤はT細胞のブレーキを外すことで抗腫瘍免疫応答を活性化させる。がん細胞に蓄積した変異が多いほど、がん細胞内で産生される変異ペプチドの種類が多く、ネオアンチゲンの数も多くなると予測される。ネオアンチゲンが多いほど、それを認識するT細胞が誘導されるチャンスが増し、チェックポイント阻害剤の効果が期待できると考えられている。免疫チェックポイント阻害剤が有効である皮膚がんや肺がんは、紫外線や喫煙のために遺伝子変異が多いことが知られているがんである。また、チェックポイント阻害剤の効果が乏しいとされた大腸がんでも、ミスマッチ修復遺伝子に異常があり体細胞変異が突出して多い一部の患者において、チェックポイント阻害剤の高い有効率が確認されている。
一方で、遺伝子変異数やneoantigenの数が少ない患者の中にも、高い抗腫瘍効果を認める症例が少なからず存在する。Merckel-cell polyomavirus (MCPyV)感染によって誘発される皮膚がんの一種であるMerckel-cell carcinoma (MCC)は、変異数が非常に少ないが抗PD-1抗体が著効することが知られている。MCPyV陽性 MCCは、ウイルス抗原に対する免疫応答が抗PD-1抗体により活性化され腫瘍の制御につながったと考えられている。これらのことから、抗腫瘍免疫においては、外来性のウイルス抗原や腫瘍特異的遺伝子変異産物など、胸腺での免疫寛容のプロセスを免れたがん抗原が高い免疫原性を持ち、腫瘍の拒絶に関与していることが明らかになった。
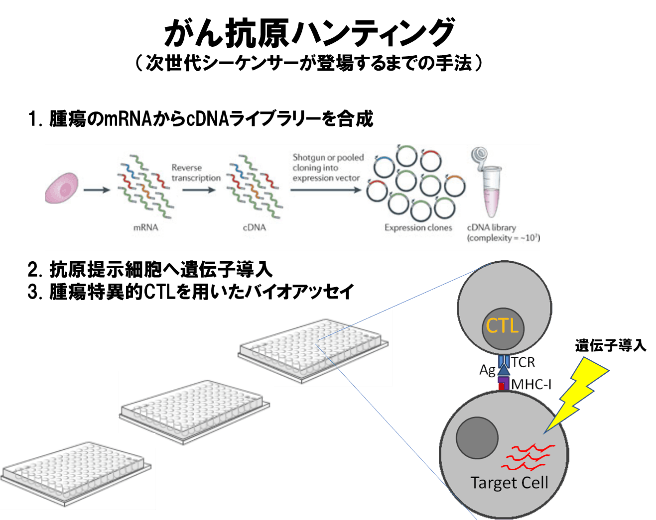
従来、免疫のターゲットとしてのがん抗原の探索には、発現クローニング法が用いられていた。がん組織からmRNAを抽出し、RT-PCRによりcDNAを合成する。この中には正常タンパクをコードするmRNAに加えて、腫瘍特異的遺伝子変異を含んだmRNAも含まれている。これらのcDNAを発現ベクターにクローニングして、cDNA発現ライブラリーを作成する。これをMHCクラスI分子を発現する細胞に遺伝子導入(トランスフェクション)して標的細胞とし、患者検体から培養して樹立した腫瘍特異的T細胞株やクローンと共培養してバイオアッセイを行う。腫瘍特異的T細胞の反応を認めた標的細胞を同定し、導入した遺伝子のシーケンス配列を確認することでがん抗原をクローニングするという方法である。この過程を何度も繰り返し、何万個のプラスミドの中から、がん抗原をコードするプラスミドを同定する作業は、非常に時間と労力を必要とした。
ここでがん抗原の探索に革新をもたらしたのが、NGSの登場である。ヒトゲノムの解読によりヒトの持つ正常な遺伝子の全容が明らかになり、更にシーケンス技術が発達し、比較的容易に個々の患者の腫瘍の全エクソンシーケンスが可能となった。また、MHC結合予測アルゴリズムを用いて、MHC ClassⅠ(あるいはClassⅡ)分子に結合しやすいエピトープの予測法を組み合わせることで、in silicoでネオアンチゲンの予測が可能になった。膨大な時間と手間を要した従来法と比較すると、非常に効率的かつ網羅的な解析方法であり、遺伝子変異をターゲットとしたがん抗原研究を大幅に促進させた。
NGSを活用したネオアンチゲン探索方法では、まずがん患者からがん組織と正常組織(血液もしくは組織)を採取し、DNA及びRNAを抽出する。全エクソンシーケンスを行い、腫瘍と正常両組織のシーケンス配列を比較して、腫瘍特異的遺伝子変異を同定する。さらにRNAシーケンスにより変異遺伝子産物の腫瘍内での発現を確認する。得られた候補の中からMHC結合能が高いエピトープを、MHC結合アルゴリズムを使用して検索する。MHC結合能が高いエピトープ候補ペプチドを合成し、腫瘍特異的T細胞との反応性を検証し、変異ペプチド反応性T細胞の誘導を試み、in vitroの系で免疫原性を確認する。TCGA(The Cancer Genome Atlas)やCOSMIC(Catalogue Of Somatic Mutation In Cancer)など、各がん種の遺伝子配列や変異がデータベース化され公開されている。これらのデータベースを活用することで、より一層in silicoのがん抗原探索研究が進展している。
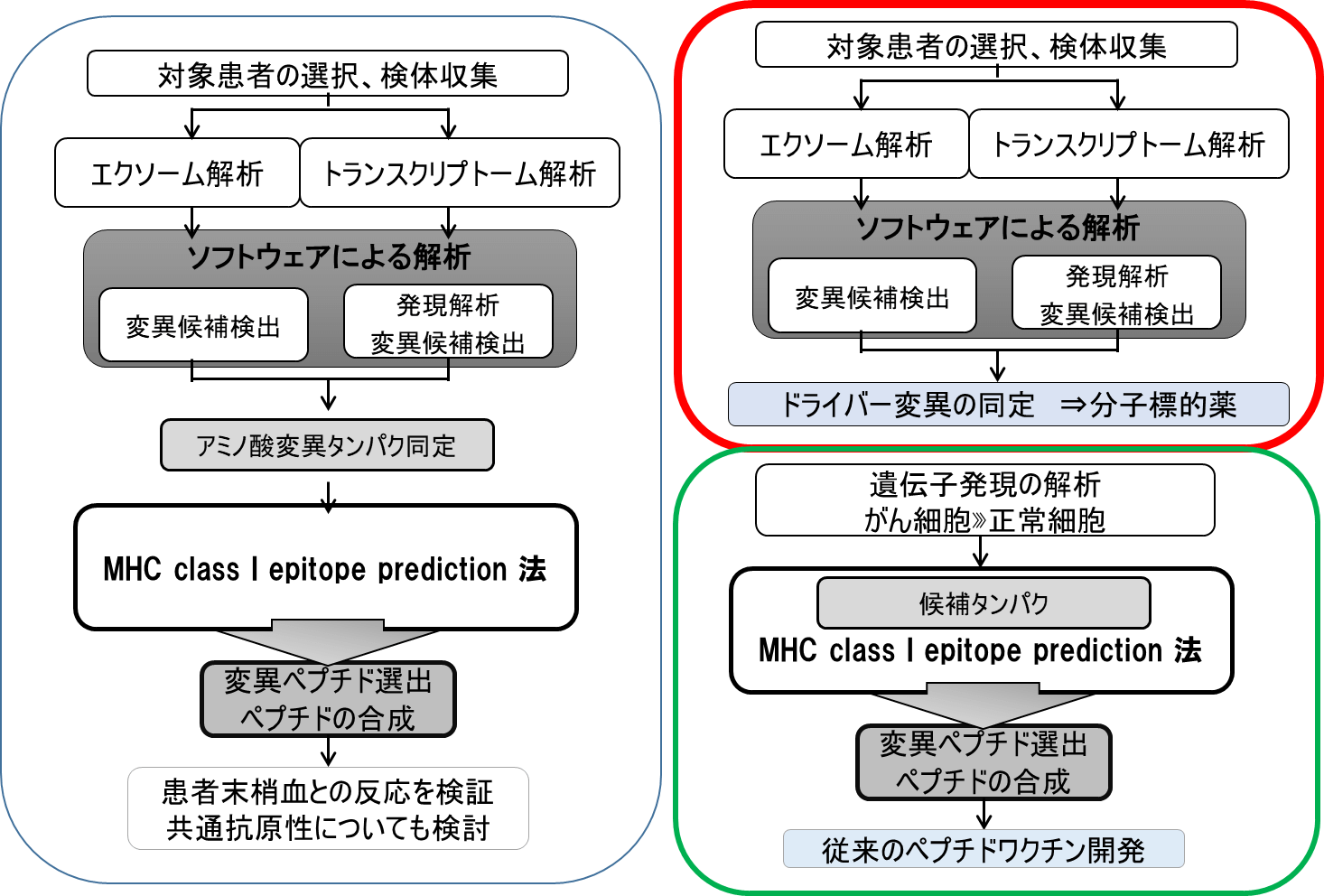
NGSを用いたネオアンチゲン予測のパイプラインといっても、実は、これまでの研究成果の統合に過ぎない、その上流は、腫瘍特異的遺伝子変異を解析し、ドライバー遺伝子を同定して分子標的薬を開発する戦略であり、その下流は、がんと正常細胞の遺伝子発現の比較からペプチドワクチンを開発する戦略である。NGSとバイオインフォマティクスの進歩のおかげで、このような作業が一気に、しかも一人一人の患者レベルで実現可能になったことから、ネオアンチゲンを標的としたがん免疫治療が可能になった。
アミノ酸配列が変化するミスセンス変異に注目してネオアンチゲンの予測がなされるが、点突然変異による1アミノ酸変異のみならず、フレームシフトやスプライシングの異常、融合遺伝子で生じた正常細胞に存在しないペプチド配列から非常に有望なネオアンチゲンを生じる可能性が高い。
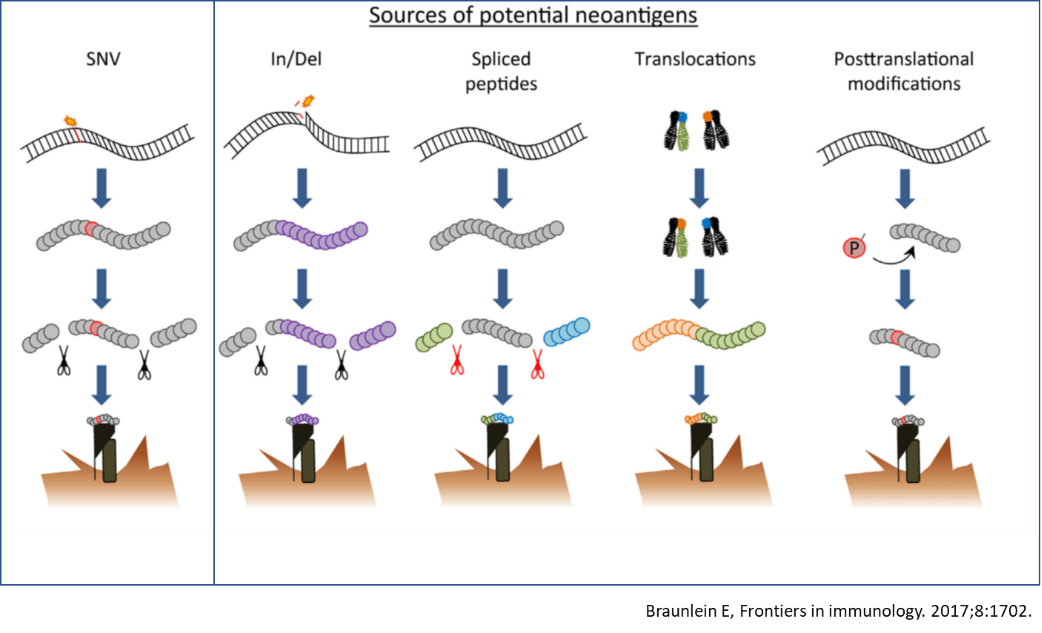
さらに、ネオアンチゲンの質を考慮する必要がある。腫瘍内には、無数のがん細胞が存在するが、がん細胞のclonality あるいはheterogeneity を考慮する必要がある。一部のがん細胞にしか発現しないネオアンチゲンを標的とした場合、ネオアンチゲンを発現しないがん細胞が免疫反応から逃避し、腫瘍の増殖を止めることが不可能である。そこで、ほぼすべてのがん細胞に存在する“クローナルネオアンチゲン”を同定する必要がある。同様に、逃避を避けるためには、細胞増殖や生存にかかわる遺伝子を標的とすることが望ましい。逆に、簡単に欠失したり発現を喪失するような不安定な部位の遺伝子は避けた方が良いと考えられる。
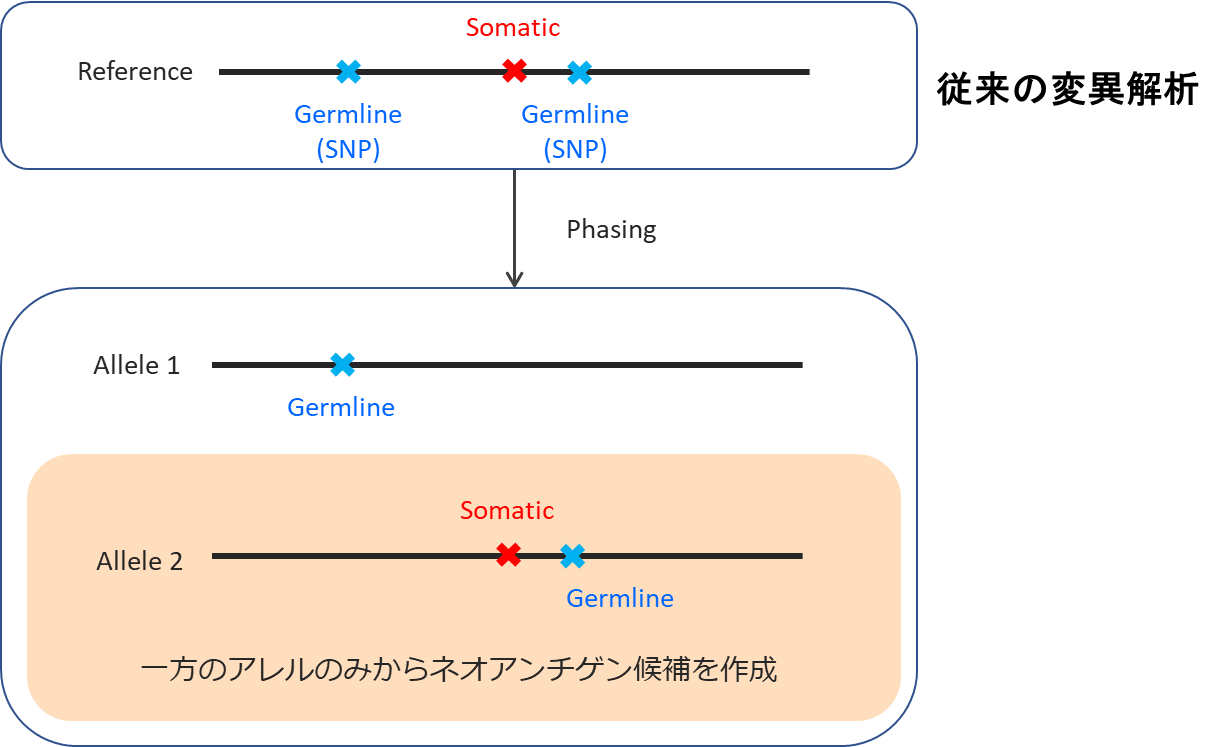
NGSを用いたネオアンチゲンペプチドの同定には、NGSの特徴を理解したうえで、アルゴリズムを構築する必要がある。2つのアレルを意識して、フェージングが必要である。
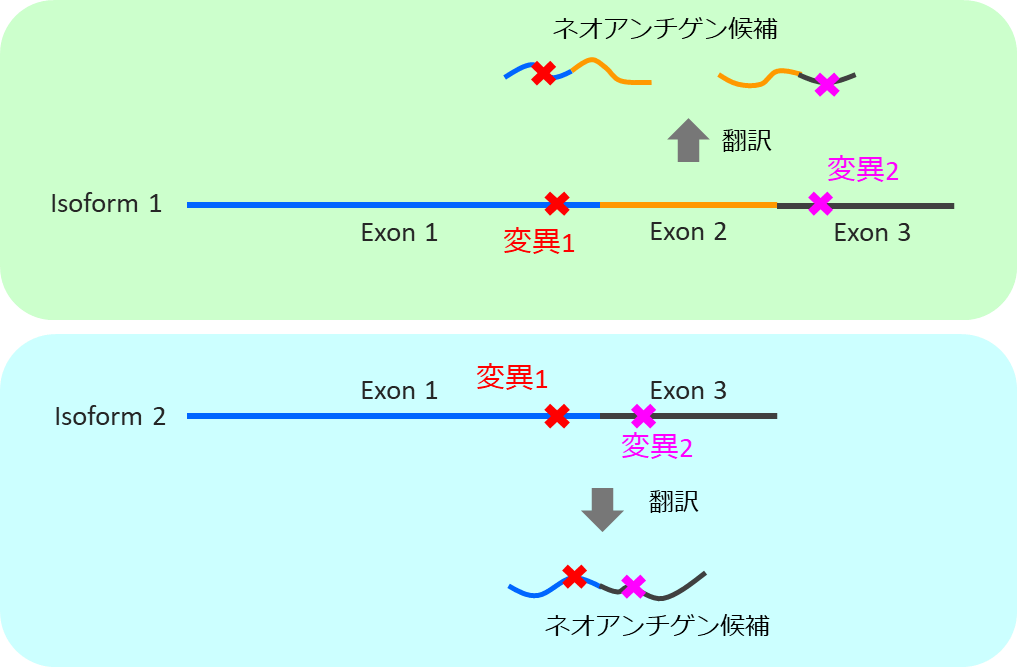
同一遺伝子上の変異でも、アイソフォームごとにネオアンチゲン候補となるペプチド配列が異なる場合がある。各アイソフォームについてネオアンチゲン候補ペプチドを作成する。
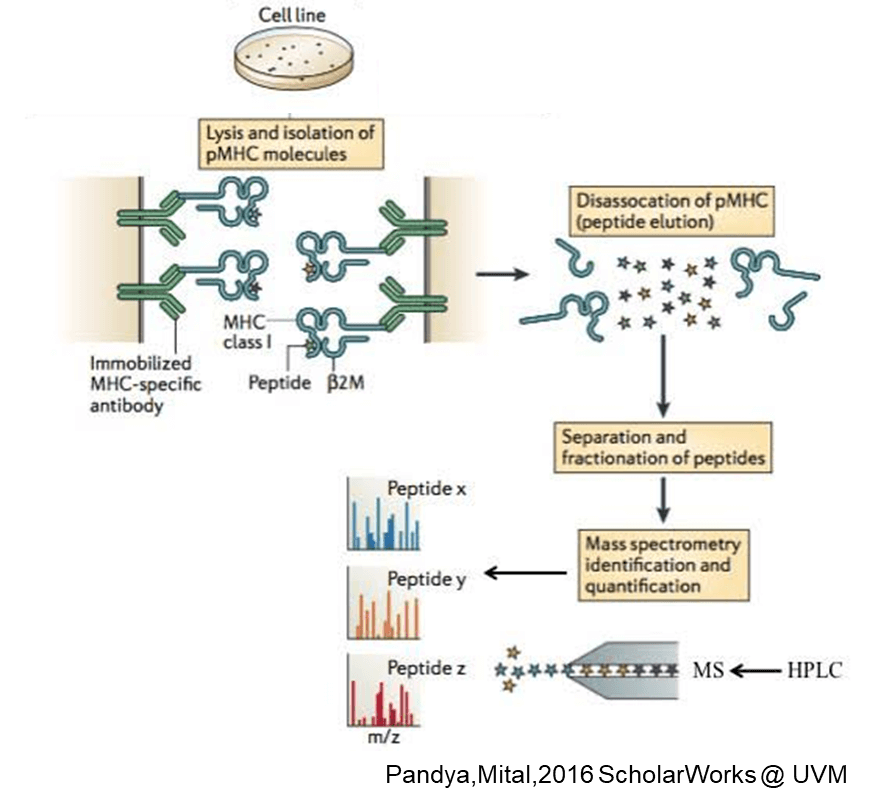
次世代シーケンサーに依存しないネオアンチゲンの探索方法も有用ながん抗原探索技術であり、解析技術とバイオインフォマティクスの進歩により研究が進んでいる。がん組織を採取、溶解処理を行い、MHCを含んだ溶解液を、MHC結合ビーズまたはカラムと結合させる。これにより、まずMHC-ペプチド複合体を濃縮することができる。pHを変化させ、MHCに結合していたペプチドを溶出すると、得られたペプチドは、がん細胞が実際に細胞表面のMHCクラスI分子によって提示していた抗原ライブラリ(HLAリガンドーム)を構成している。これらのペプチドのアミノ酸配列をLC-MS/MSで解析することでMHC結合ペプチドを同定する。抗原の予測ではなく実際にMHCに結合している抗原を解析することができるという点がこの手法の最大のメリットであるといえる。現在、次世代シーケンサーによる手法とこのMHC結合ペプチド解析法を組み合わせたがん抗原の探索方法が注目を集めている。
in silicoで予測されたネオアンチゲンも、MHCに結合していたペプチドも、いずれにしても、実際に腫瘍特異的T細胞と反応するかどうかの検証が必要であり、昔ながらの多くの時間と労力を要するバイオアッセイを避けることは不可能である。