Tumor
Immunity腫瘍免疫の基礎知識(垣見の腫瘍免疫学)
免疫細胞治療学講座で実施している研究のベースとなる腫瘍免疫に関する基礎知識、考え方を概説します。
5.がんとの闘いを司令官として考えてみる
5.1.自己の兵力
兵士:中心は、腫瘍特異的CD8+T細胞、CTL、ほかに免疫担当細胞が複数存在
 がん細胞と兵士のバトル(1対1)
がん細胞と兵士のバトル(1対1)
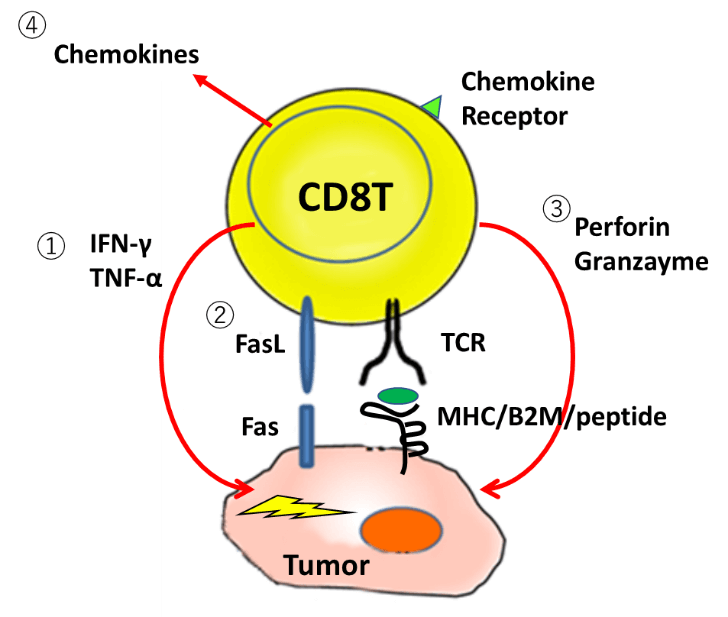
どうやって敵を見つけるか?TCR受容体で、がん抗原、MHCペプチド複合体、ネオアンチゲンを認識し、がん細胞と正常細胞を識別できる。
どうやって敵を倒す?:CTLのエフェクター機能、IFN-γ、TNF-αなどのサイトカイン産生、パーフォリン、グランザイムなどの細胞傷害顆粒の放出、細胞死を誘導する分子Fasの発現などを持っているはず。ケモカインを産生して、援軍を呼ぶこともできる。あるいはケモカイン受容体で応援に駆け付けることができる。
免疫を理解する上で、兵士(T細胞)と軍隊(T細胞プールとかポピュレーションと表現される、さらにT細胞以外の免疫細胞を含んだ細胞集団)の区別が必要です。戦場(腫瘍)への軍隊の投入プロセスには、まず新兵(ナイーブT細胞)に経験(抗原認識)を積ませてトレーニングして、エフェクター細胞に仕上げることが必要。それにはCancer Immunity Cycleのプログラムが存在する。
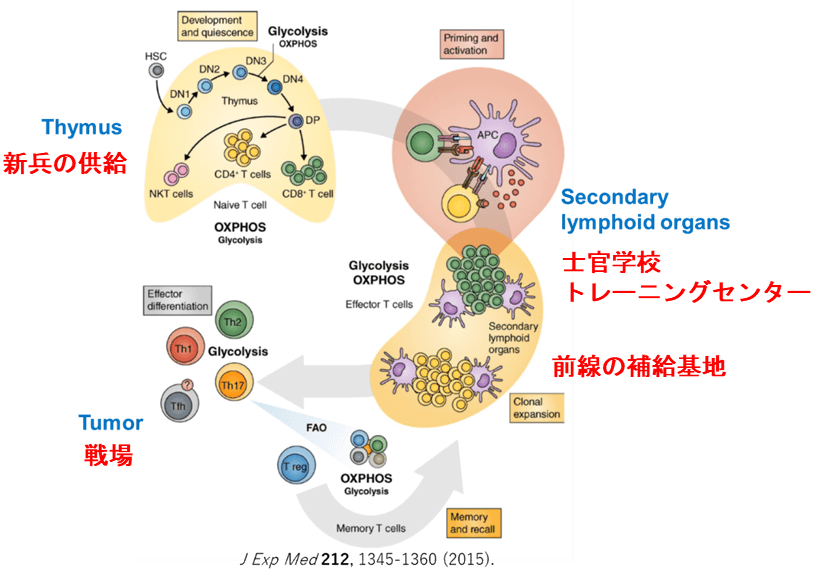
5.2.新兵からベテランソールジャーへ(T細胞分化のプログラム)
免疫の特徴は、「抗原特異性」と「メモリー」である。これは、まさにT細胞により規定される。
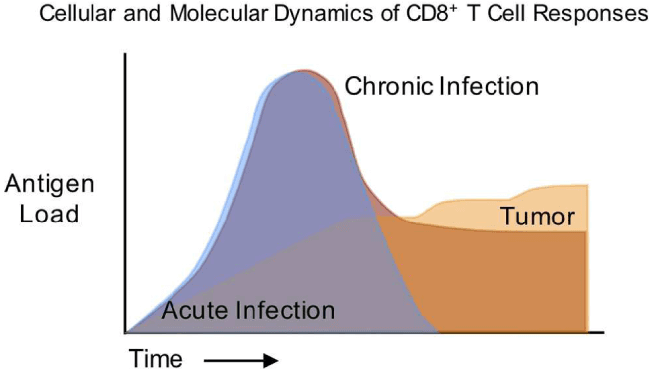
急性ウイルス感染症の場合、ウイルス感染によって抗原量が増加するが、免疫系により感染が制御されると、ウイルス量は検出されなくなる。抗原量の変化と同様に、抗原特異的T細胞の反応もクローナルに増殖したT細胞のピークを認めるが、活性化されたT細胞の多くはActivation induced cell deathに陥り細胞数が減少する。一部の細胞集団がメモリー細胞として長期間残存することが知られている。
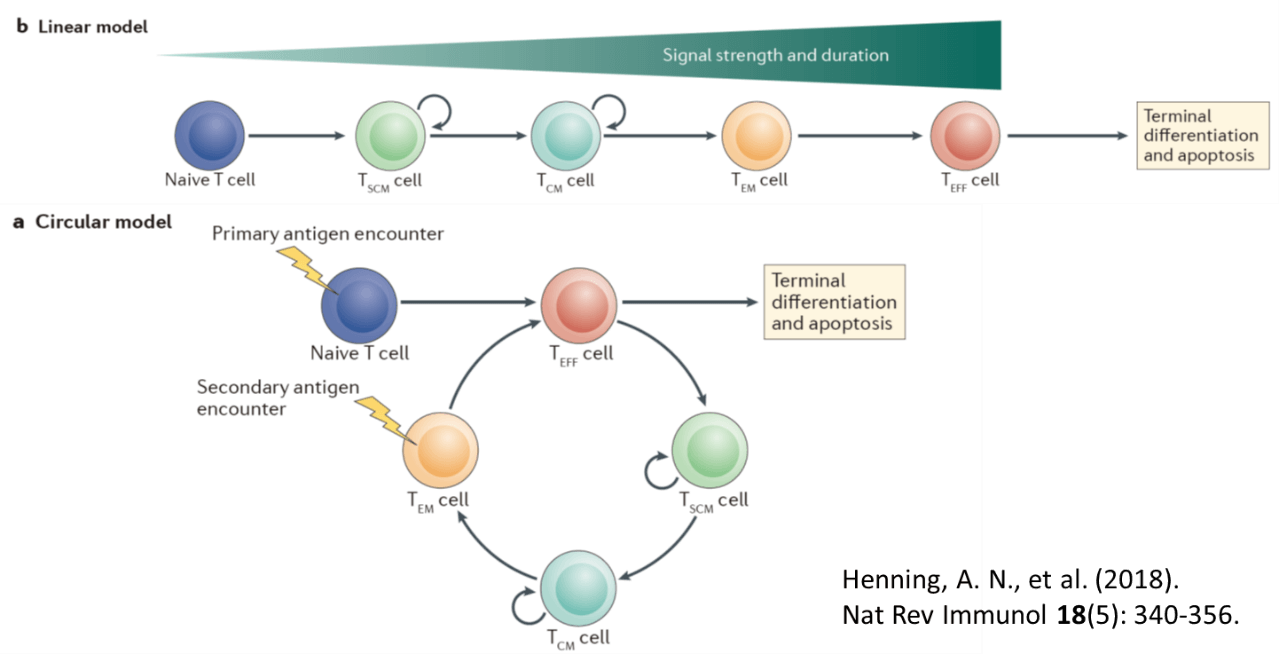
ナイーブT細胞は抗原刺激を受け、分裂を繰り返すとともに、エフェクター細胞へ分化し、最終的にはアポトーシスに陥る。一部の細胞は、分裂増殖能を持ったステムセルメモリーT細胞、セントラルメモリーT細胞、エフェクターメモリーT細胞へと分化し、再度の抗原刺激を受けたものがエフェクターT細胞になるが、抗腫瘍エフェクター活性が強いエフェクターT細胞や疲弊T細胞は細胞増殖能を喪失し、最終分化段階を経てアポトーシスに陥る。一方幼弱な細胞はエフェクター活性は弱いものの、細胞増殖活性を保ち、数を維持することに貢献できる。
慢性ウイルス感染症の場合、免疫系の働きにより、ウイルス量はピークを越えた後、ある程度制御されるが、完全に封じ込めることはできず、持続感染状態が継続する。抗腫瘍免疫応答の場合も、慢性持続感染に対する免疫応答と共通の部分が認められるが、抗原量はピークを形成することなく持続的に増加し続ける点が異なる。このように抗原刺激・TCRからの刺激が持続する場合、T細胞はexhaust(疲弊)状態に陥る。循環系から組織に浸潤したレジデントメモリーT細胞も加えて、様々な分化段階のT細胞は、細胞表面のマーカーや、転写因子の発現で識別される。
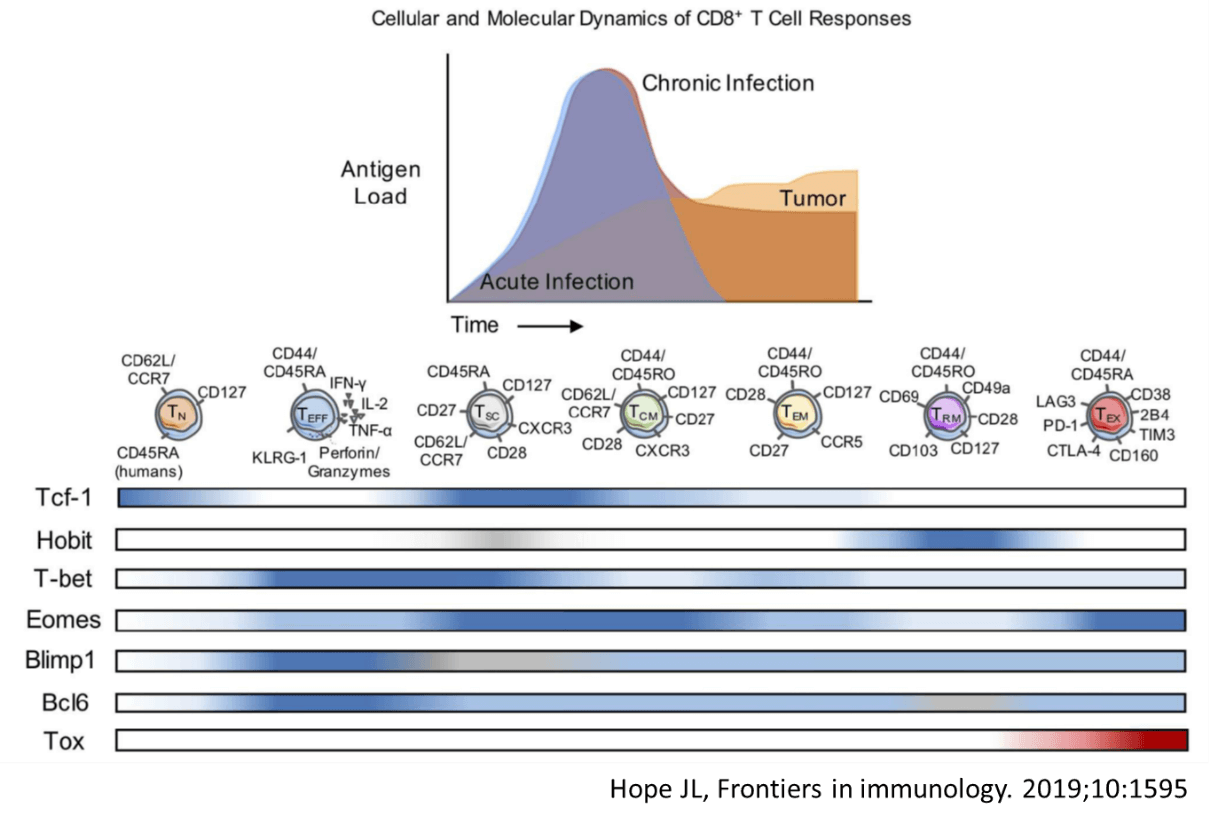
腫瘍内に浸潤したT細胞は、様々な分化段階のT細胞からなるヘテロな集団である。免疫チェックポイント阻害剤の効果が期待できる患者の腫瘍内には、同じようにPD-1分子を発現した疲弊細胞であっても、まだ細胞増殖能を保ったメモリー様の疲弊T細胞の存在が必要であり、細胞増殖能を完全に喪失してしまった最終分化型疲弊T細胞が優位な腫瘍では、効果がむつかしいことが明らかになってきた。
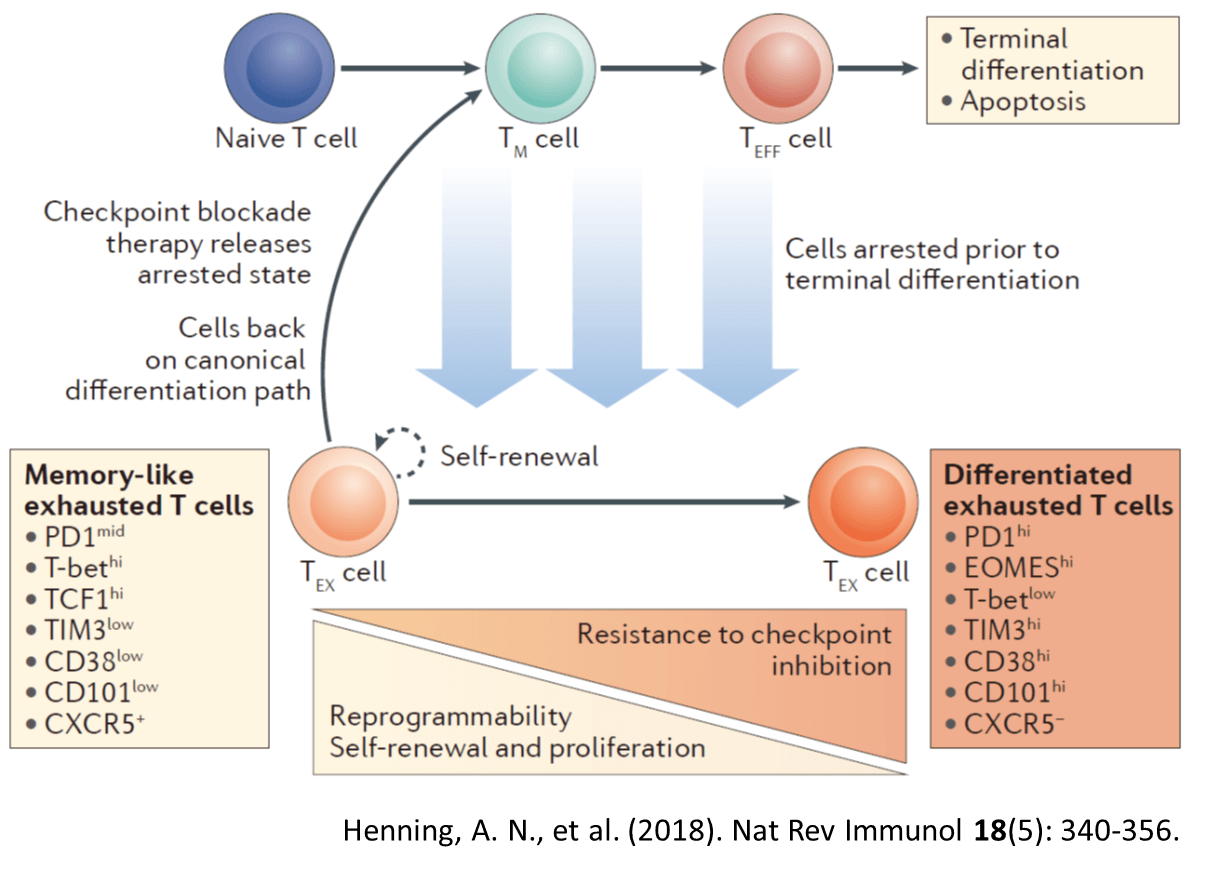
免疫チェックポイント阻害剤のメカニズムは、当初はアクセルとブレーキで説明されていた。これは兵士とがん細胞の1対1のバトルを想定した説明である。これは複雑な抗腫瘍免疫応答(戦い)の説明には物足りない。
免疫チェックポイント阻害剤のメカニズムは、「腫瘍特異的免疫応答の再活性化」として説明されるようになっている。この再活性化は、「戦いで傷ついた戦士が、治療を受けて再び元気になって戦場で活躍する」というシナリオではない。ここで兵士ではなく、軍隊としてT細胞の集団、免疫を考えることが役立つ。免疫チェックポイント阻害剤治療によって、疲弊T細胞の中でも分裂能を保つT細胞が増殖を開始しすることが明らかになってきた。
傷ついた兵士に期待するのではなく、若い戦士を軍隊に加え、数を増やすことでがんとの闘いを有利に進めることができた時、がんを制御できるのである。
5.3.籠城戦
強大な敵を前に、突撃して玉砕を選ぶことが正しい選択とは限らない。籠城して戦力を保持し、時を待つ戦い方もある。B型肝炎ウイルスは急性肝炎、劇症肝炎、慢性肝炎の病態を取ることが知られている。免疫応答により生体には発熱や炎症反応が認められ、あたかも戦争で街が空襲にあったような状態になる。戦いに勝てば、敵がいなくなり街や国は復興できる。ところが、あまりにも激しい戦闘がいつまでも続くと、国土が荒れ果ててしまう、これが劇症肝炎の状態である。慢性ウイルス感染症やがんに対する免疫応答など、抗原量が多くこのまま免疫応答を刺激し続けると破壊が進み、むしろ生命を脅かすのではないか(immunopathologyと呼ばれる状態、コロナウイルス肺炎でも認められる)と判断される場合、免疫系は「籠城作戦」を選択するようにプログラムされている。Exhaust T細胞は、まさにこの籠城作戦にでた兵士たちである。
活性化T細胞は抗原の再刺激に対して、アポトーシスに陥ってしまう。抗原刺激が続く慢性感染症やがんなど、TCRからの刺激が持続する場合、Exhaust CD8+T細胞はTOXという転写因子が発現し、籠城戦に入ることを決断する。過度な攻撃をやめる代わりに、長期間にわたり免疫応答を持続するようにプログラムされている。籠城が始まって早いうちに、免疫チェックポイント阻害剤治療が開始されると、T細胞が分裂して、優位になった軍隊が敵(がん)を制圧できる可能性が高い。しかし、援軍(免疫チェックポイント阻害剤治療)が遅れると、さすがにExhaust T細胞も分裂能を喪失しており反応不可能に陥るのである。
不老不死のソールジャーを作ることはできない。若い兵士をどんどん訓練して(Cancer Immunity Cycleを回して)、増殖させて、軍隊としての活力をいつまでも持続させることが重要である。
5.4.数的に圧倒的不利な戦をどうする?
がんと免疫を考えると、がん細胞の方が圧倒的に数が多い、「多勢に無勢」の状態である。籠城戦だけではない、担癌マウスを用いて私たちが証明した免疫の巧妙な仕組みを紹介したい。
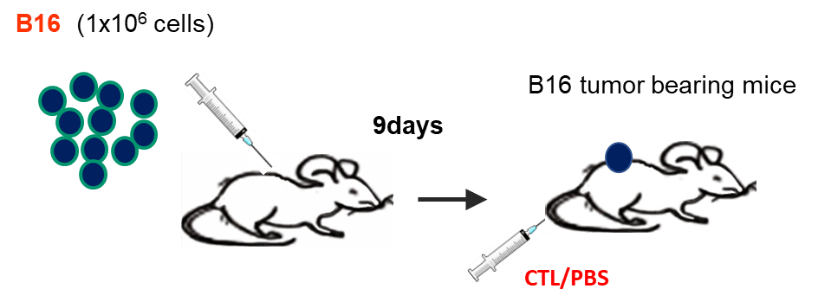
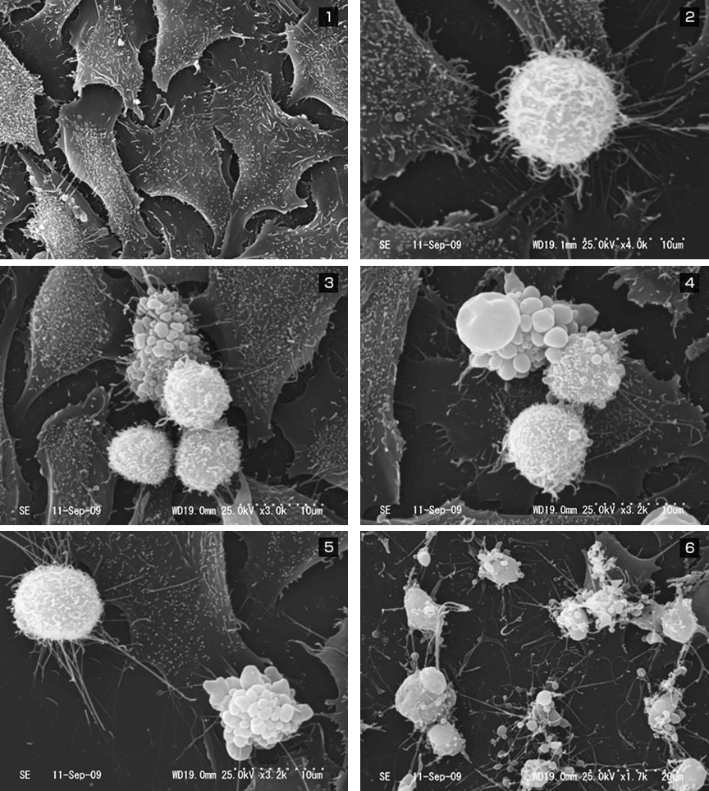
担癌マウスに対するCTL治療モデルにおいて、CTLの投与を受けたマウスでは、腫瘍の増殖が抑制される。投与の翌日(Day 1)には、腫瘍内に浸潤したCTLがフローサイトメーター(CD8+Thy1.1+)でも、免疫組織染色(青)でも確認される。CTLの腫瘍浸潤に一致して、がん細胞の破壊を認め、壊死に陥った領域が拡大している像を認める。
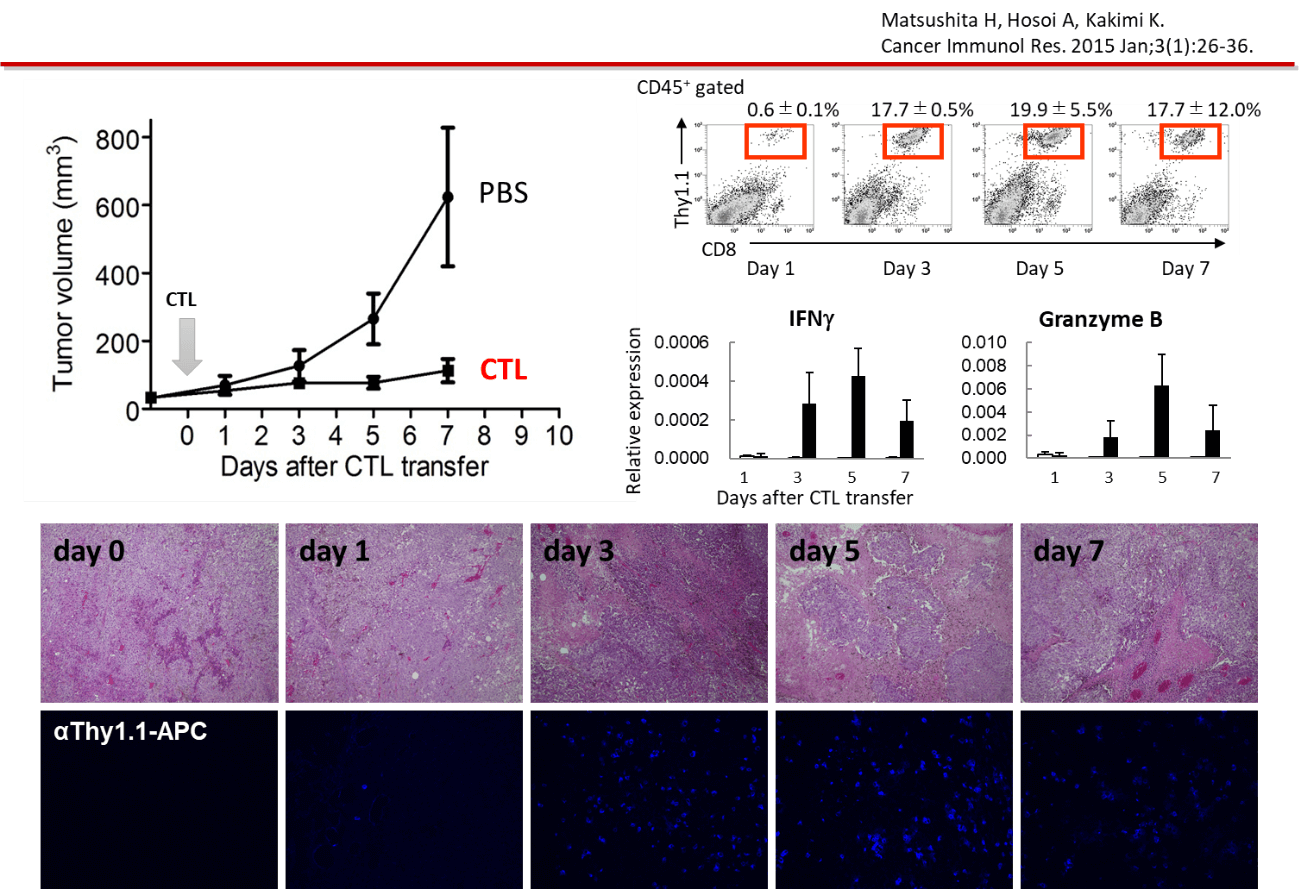
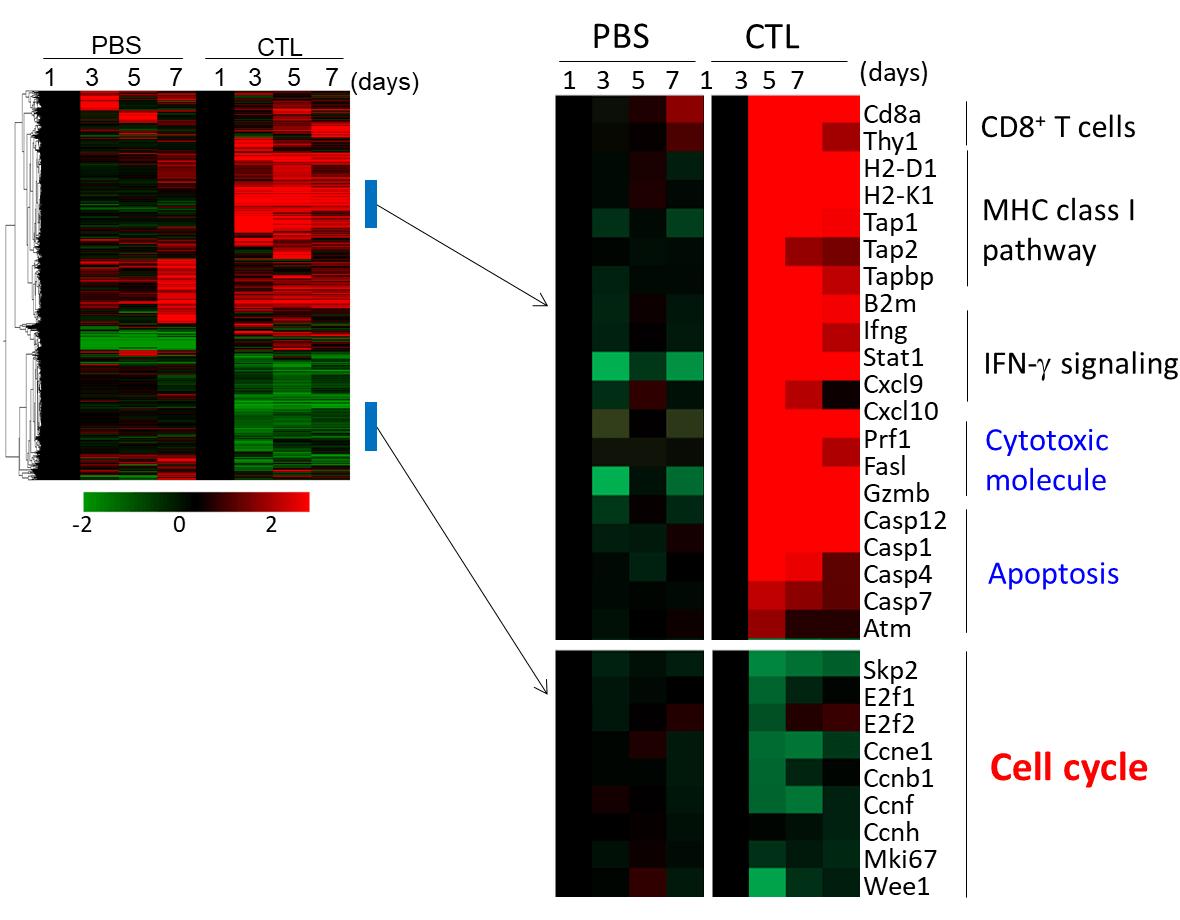
腫瘍内の免疫応答を評価するため腫瘍のRNAを抽出し遺伝子発現を経時的に評価した。コントロールの未治療の腫瘍と比べて、CTLの投与を受けた腫瘍では、CTLの腫瘍内への浸潤に伴うCD8+T細胞のシグナル、細胞傷害分子の発現、抗原認識に伴うIFN-γシグナル、その下流のMHCクラスI抗原提示経路、アポトーシス関連遺伝子の発現亢進を認めた。一方、CTL治療を受けた腫瘍内では、細胞周期に関連する遺伝子発現が低下していた。
そこで、細胞周期によって赤/緑の蛍光発色するFucciシステムを導入したB16がん細胞に対するCTL治療を行った。
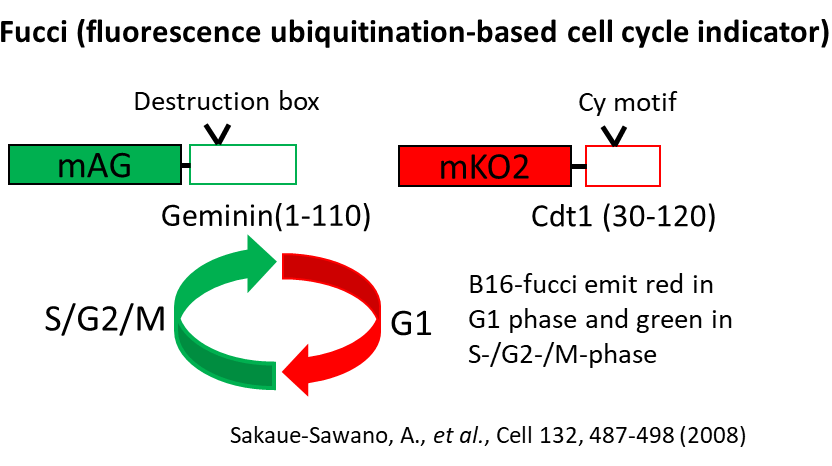
担癌マウスにCTL治療を実施したところ、無治療のマウスの腫瘍では、S/G2/M期を示す緑の蛍光優位であったが、CTLが腫瘍に浸潤した治療群では、G1期を示す赤の蛍光を示しがん細胞の細胞周期がG1期で停止していることが明らかになった。
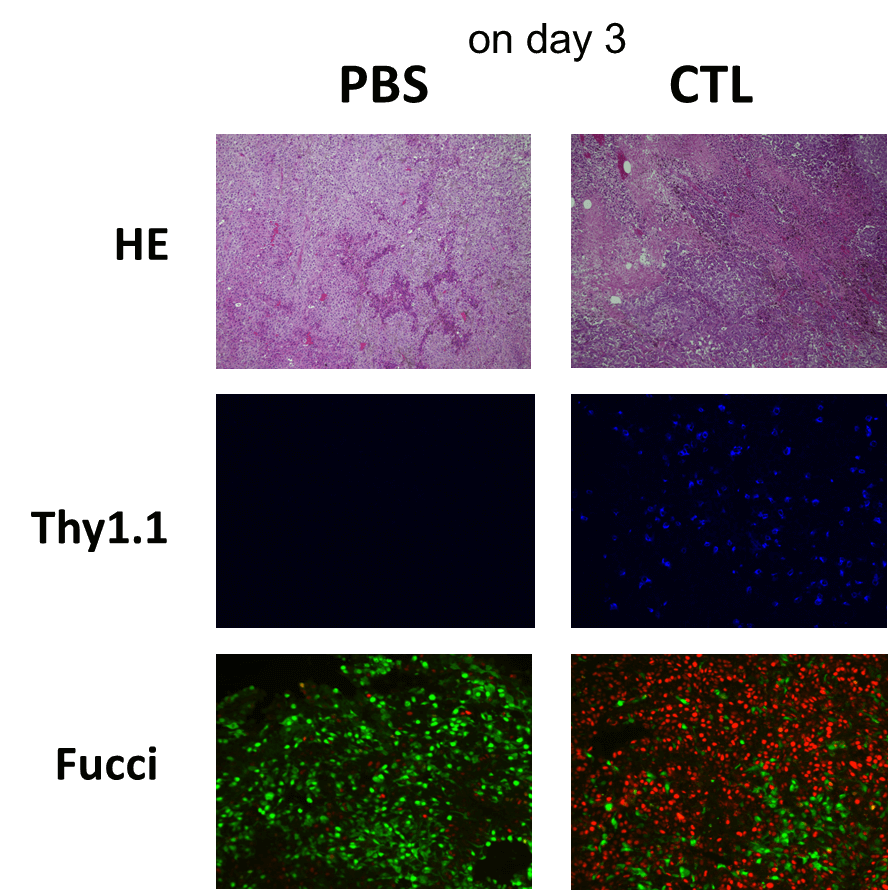
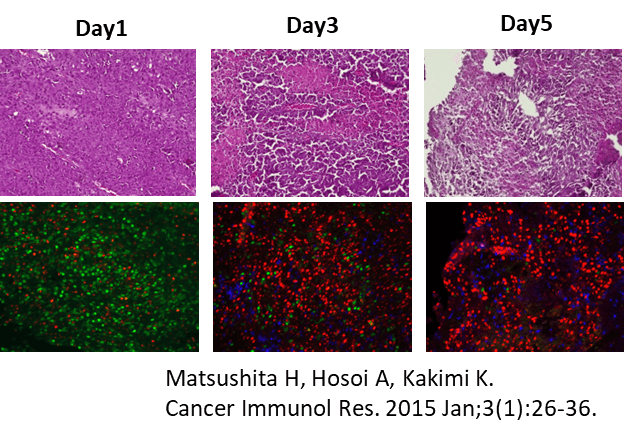
CTL浸潤のピークであるDay 5の病理像では、CTLによる細胞傷害活性による壊死領域の拡大を認め、ほぼすべてのがん細胞がG1 arrestの状態であった。細胞周期の停止は、CTLからのIFN-γの作用によるものと考えられたため、CTL治療にIFN-γの中和抗体を投与した。
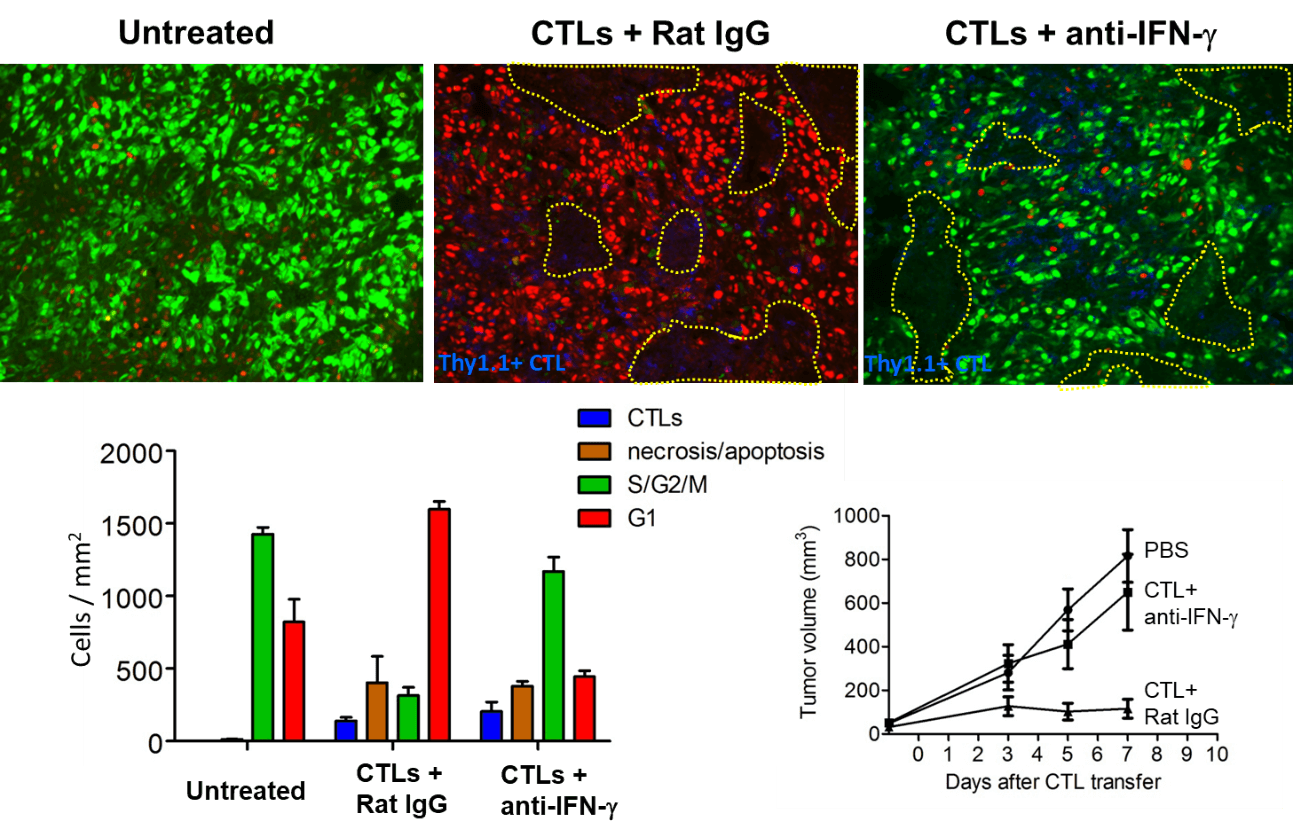
無治療のマウスでは腫瘍増殖を認めたが、CTL治療マウス(コントロール抗体投与)では、腫瘍の増殖が抑えられた。しかしながら、CTL治療時に、IFN-γの作用を阻害する中和抗体の投与を受けたマウスでは、未治療群よりはわずかに腫瘍の増殖は抑制されたものの、CTLによる腫瘍増殖抑制作用はほぼキャンセルされていた。免疫染色でS/G2/M期にあるがん細胞(緑)、G1期のがん細胞(赤)、壊死/アポトーシス(茶)に陥ったがん細胞を評価すると、抗IFN-γ抗体の有無を問わず、CTLによる壊死/アポトーシス領域はほぼ同程度であったにもかかわらず、、抗IFN-γ抗体投与群では、G1期のがん細胞(赤)が減少しS/G2/M期にあるがん細胞(緑)が増加していた。このように、IFN-γを介した細胞増殖の阻止が、腫瘍増殖抑制に非常に重要であることを明らかにした
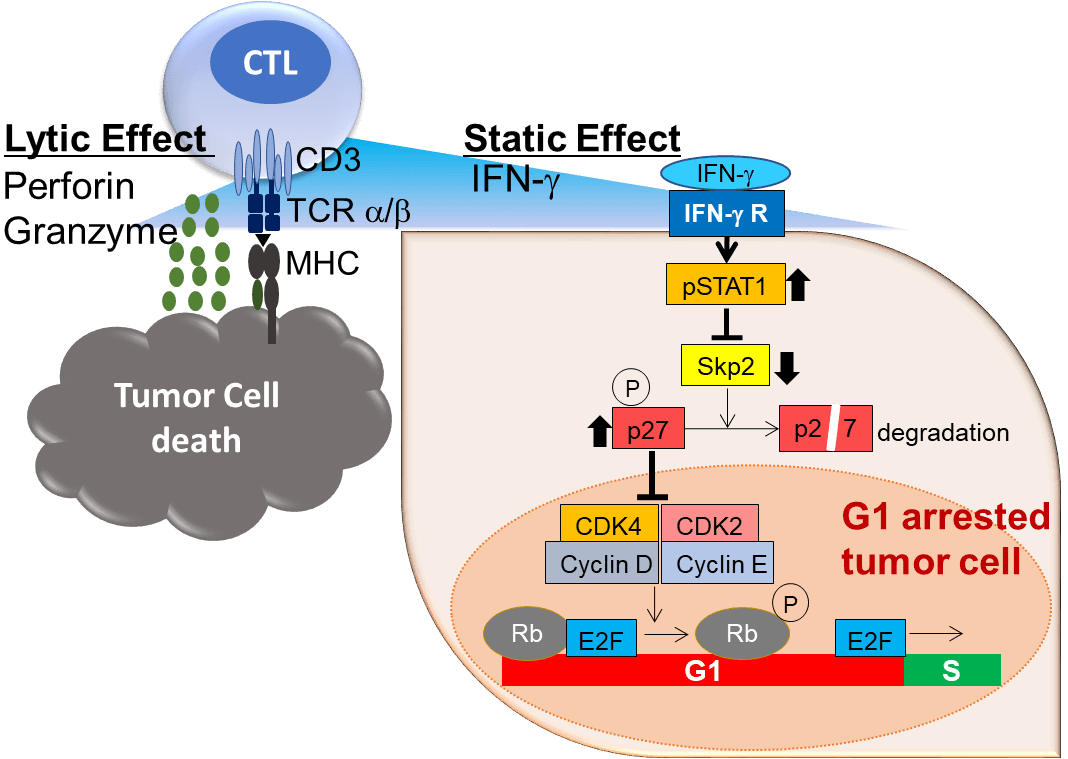
CTLは、TCRでがん細胞上のMHCペプチド複合体を認識すると、細胞傷害活性によってがん細胞をアポトーシスに陥れる(Lytic Effect)。同時に、CTLはIFN-γを放出し、周囲に存在する複数の細胞の細胞周期を停止させる(Static effect)。
多勢に無勢の状況下では、1対1のバトルでがん細胞をつぶしていくだけではとても間に合わないが、免疫系はINF-γを用いて、一度に複数の細胞をおとなしくさせることで、がんの増殖を制御していることを明らかにした。
この論文をCancer Immunology Researchに投稿したところ、高い評価を受け、”Cytotoxic T-cell Cytokines Put cancer Under Arrest”としてEditorialに紹介された。
